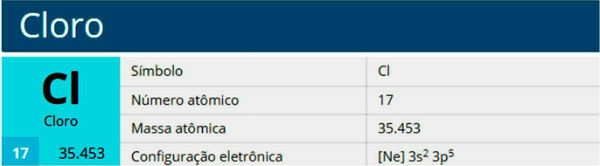
क्लोरीन एक रासायनिक तत्व है जिसका प्रतीक Cl, परमाणु क्रमांक 17, परमाणु द्रव्यमान 35.5 है। यह हलोजन परिवार, समूह 17 या 7A, और आवर्त सारणी के तीसरे आवर्त से संबंधित है।
इसका नाम ग्रीक से निकला है ख्लोरोस, जिसका अर्थ है हरा-भरा। ऐसा इसलिए है क्योंकि तापमान और दबाव की सामान्य परिस्थितियों में, क्लोरीन को एक तेज गंध वाली हरी-पीली गैस के रूप में जाना जाता है।
विशेषताएं
क्लोरीन की खोज 1774 में स्वीडिश वैज्ञानिक कार्ल विल्हेम शीले (1742-1786) ने की थी। हालांकि, उस समय मेरा मानना था कि यह ऑक्सीजन वाला यौगिक है। 1810 में, हम्फ्री डेवी (1778-1829) ने प्रदर्शित किया कि यह एक नया रासायनिक तत्व था।
चूंकि यह एक अत्यंत प्रतिक्रियाशील तत्व है, यह प्रकृति में अपने शुद्ध रूप में शायद ही पाया जाता है, एचसीएल के रूप में ज्वालामुखी विस्फोट के दौरान उत्सर्जित छोटी मात्रा को छोड़कर।
इस प्रकार, यह आमतौर पर सोडियम क्लोराइड (NaCl) के रूप में पाया जाता है, जिसे टेबल सॉल्ट भी कहा जाता है। खनिजों में, यह कार्नेलाइट और सिल्वाइट के रूप में होता है।
इसे द्वारा भी प्राप्त किया जा सकता है इलेक्ट्रोलीज़
NaCl, जलीय घोल में। क्लोरीन क्लोराइड से कई लवण भी उत्पन्न करता है की प्रक्रिया के माध्यम से ऑक्सीकरण.और जानें, ये भी पढ़ें:
- आवर्त सारणी
- रासायनिक तत्व
- हैलोजन
अनुप्रयोग
क्लोरीन गैस (Cl .)2) विषाक्त और परेशान करने वाला है, इस स्थिति के कारण इसे प्रथम विश्व युद्ध के दौरान एक रासायनिक हथियार के रूप में इस्तेमाल किया गया था। यह गैस श्वसन पथ और त्वचा में जलन पैदा करती है, फेफड़ों में पानी की अवधारण, फाड़ और बड़ी मात्रा में साँस लेने पर मृत्यु का कारण बन सकती है।
क्लोरीन के कुछ अन्य उपयोग हैं:
- क्लोरीन डाइऑक्साइड (ClO .) का उपयोग करके कागज और कपड़ों का विरंजन2).
- जल उपचार, क्लोरीन के अतिरिक्त पानी पीने योग्य और मानव उपभोग के लिए उपयुक्त बनाता है। इस प्रक्रिया को क्लोरीनीकरण कहा जाता है और इसमें हाइपोक्लोरस एसिड (HClO) का उपयोग किया जाता है।
- स्विमिंग पूल के पानी और औद्योगिक कचरे की कीटाणुशोधन, क्योंकि क्लोरीन सूक्ष्मजीवों को मारने में सक्षम है।
- पीवीसी (पॉलीविनाइल क्लोराइड) और सिंथेटिक रबर जैसे प्लास्टिक यौगिकों का उत्पादन।
- कुछ प्रकार के कार्बनिक और अकार्बनिक यौगिकों का उत्पादन।

