विलयन दो या दो से अधिक पदार्थों का समांगी मिश्रण होता है।. जैसे, उदाहरण के लिए, पानी (विलायक) में घुले नमक (विलेय) का घोल।

विशेष रूप से रासायनिक प्रयोगशालाओं और उद्योगों में, यह प्रक्रिया बहुत महत्वपूर्ण है, क्योंकि रसायनज्ञ को ज्ञात सांद्रता के साथ समाधान तैयार करने की आवश्यकता होती है। इसके अलावा, प्रयोगात्मक गतिविधियों में, बहुत कम सांद्रता वाले समाधानों का उपयोग किया जाता है, इसलिए केंद्रित समाधान का एक नमूना वांछित एकाग्रता तक पतला होता है।
दैनिक आधार पर, कई बार, इसे साकार किए बिना, हम घोल को पतला करने की प्रक्रिया को अंजाम देते हैं। उदाहरण के लिए, सफाई और घरेलू स्वच्छता उत्पादों की पैकेजिंग, जैसे कि कीटाणुनाशक, सलाह देते हैं कि उन्हें उपयोग करने से पहले पतला किया जाए। कुछ निर्माता उत्पाद लेबल पर सुझाव देते हैं कि इसे 1 से 3 के अनुपात में पानी से पतला किया जाना चाहिए, अर्थात उत्पाद के प्रत्येक भाग के लिए पानी के 3 भाग जोड़े जाने चाहिए। ऐसा इसलिए किया जाता है क्योंकि उत्पाद बहुत केंद्रित और मजबूत होता है और अगर इसे सही तरीके से पतला न किया जाए तो यह उस जगह को नुकसान पहुंचा सकता है जहां इसे लगाया जाएगा। दूसरी ओर, यदि आप इसे आवश्यकता से अधिक पतला करते हैं, तो आप पैसे खो सकते हैं, क्योंकि उत्पाद वांछित परिणाम प्राप्त नहीं करेगा।

एक और उदाहरण है जब हम जूस बनाते हैं। कई रसों के सांद्रों के लेबल से संकेत मिलता है कि एक गिलास रस को पतला या 5 गिलास पानी में मिलाना चाहिए। इस प्रकार, रस "कमजोर" है, अर्थात कम केंद्रित है।
अब मत रोको... विज्ञापन के बाद और भी बहुत कुछ है;)
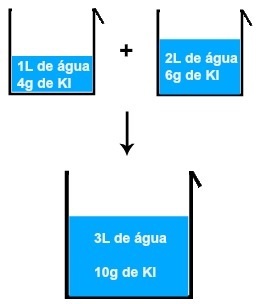
कल्पना कीजिए कि आपने इस तरह के रस को 3 लीटर पानी में पतला कर दिया है। यदि प्रारंभिक रस की सांद्रता 40g/L थी, तो इसका मतलब है कि प्रत्येक लीटर विलायक के लिए इसका द्रव्यमान 40g था। लेकिन चूंकि हमारे पास ३ एल होगा, द्रव्यमान को ३ से विभाजित किया जाएगा और फिर प्रत्येक लीटर घोल के लिए एकाग्रता लगभग १३, ३३ ग्राम/ली, या १३ ग्राम होगी। हालाँकि, पूरे घोल में 40g विलेय का द्रव्यमान अभी भी बना हुआ है।
इस नई सांद्रता की गणना निम्नानुसार की जा सकती है:
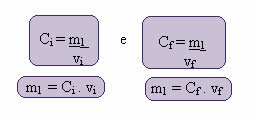
जहां सूचकांक i और f क्रमशः प्रारंभिक और अंतिम मानों का प्रतिनिधित्व करते हैं। चूँकि m1 का मान नहीं बदला है, हम समीकरणों को बराबर कर सकते हैं:
सीमैं. वीमैं = सीएफ. वीएफ
पिछले उदाहरण के अनुसार, हमारे पास मौजूद मूल्यों को बदलना, ध्यान दें:
प्रारंभिक समाधान:
सीमैं: ४० ग्राम/ली
एम1: 40जी
वीमैं: 1ली
अंतिम समाधान:
सीएफ: ?
एम1: 40जी
वीएफ: ३एल
सीमैं. वीमैं = सीएफ. वीएफ
(४० ग्राम/ली). (1 एल) = सीएफ. ३एल
सीएफ = ४० ग्राम/ली
3
सीएफ = १३.३३३ ग्राम/ली
यही तर्क दाढ़ की सांद्रता (M) और विलेय या अनुमापांक (T) के द्रव्यमान के प्रतिशत के लिए भी मान्य है:
ममैं. वीमैं = एमएफ. वीएफ तथा टीमैं. वीमैं = टीएफ. वीएफ
जेनिफर फोगाका द्वारा
रसायन विज्ञान में स्नातक
ब्राजील स्कूल टीम
क्या आप इस पाठ को किसी स्कूल या शैक्षणिक कार्य में संदर्भित करना चाहेंगे? देखो:
FOGAÇA, जेनिफर रोचा वर्गास। "समाधान का कमजोर पड़ना"; ब्राजील स्कूल. में उपलब्ध: https://brasilescola.uol.com.br/quimica/diluicao-solucoes.htm. 27 जून, 2021 को एक्सेस किया गया।