Une solution tampon est un mélange utilisé pour empêcher le pH ou le pOH du milieu de changer lorsque des acides forts ou des bases fortes sont ajoutés.
Il existe deux types de solution tampon :
1. Mélange d'acide faible avec sa base conjuguée ;
2. Mélange de base faible avec son acide conjugué.
Regardons des exemples de chacun et comment ils fonctionnent lorsqu'une petite quantité d'acide ou de base forte est ajoutée au milieu :
1. Mélange d'acide faible avec sa base conjuguée :
Pour former une telle solution, l'acide faible est mélangé avec un sel du même anion que l'acide.
Par exemple, considérons une solution tampon constituée d'acide acétique (H3CCOOH(ici)) et l'acétate de sodium (H3CCOONa(s)). Voir que les deux ont l'anion acétate: (H3CCOO-(ici)). La concentration de ces ions est pratiquement due à la dissociation du sel, qui est importante. L'ionisation acide est faible.

Remarquez maintenant ce qui se passe dans les possibilités d'ajout suivantes :
- Ajout d'une petite quantité d'acide fort :
L'ajout d'un acide fort augmente la concentration de l'ion hydronium, H3O+1, et comme l'acide acétique est un acide faible, l'anion acétate a une grande affinité pour le proton (H+) hydronium. De cette façon, ils réagissent et plus d'acide acétique se forme :

De ce fait, le pH du milieu ne change pratiquement pas. Cependant, si de plus en plus d'acide fort est ajouté, le moment viendra où tout l'anion acétate sera consommé et l'effet tampon cessera.
- Ajout d'une petite quantité de base forte :
L'ajout d'une base forte augmente la concentration en ions OH-. Mais ces ions sont neutralisés par les ions H3O+1 libéré lors de l'ionisation de l'acide acétique :

Avec cette réaction, la concentration des ions H3O+1(ici) diminuera et il y aura un décalage de l'équilibre dans le sens d'une augmentation de l'ionisation de l'acide et, par conséquent, la variation de pH de la solution sera très faible. La concentration des ions H3O+1(ici) il sera pratiquement constant.
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
Dans ce cas, il existe également une capacité de plafond limite. Par conséquent, si l'on ajoute de plus en plus de base, l'équilibre de l'ionisation de l'acide se déplacera de plus en plus vers son ionisation, jusqu'à ce que tout l'acide soit consommé.
2. Mélange d'une base faible avec son acide conjugué :
Ce type de solution tampon est composé d'une base faible et d'une solution saline qui contiennent le même cation que la base.
Par exemple, considérons une solution tampon formée d'hydroxyde de magnésium, MgOH2(aq) (base faible) et chlorure de magnésium, MgCl2(s) (sel). Les deux contiennent le cation magnésium (Mg2+(ici)). Les ions magnésium présents dans le milieu sont pratiquement tous issus de la dissociation du sel, car la dissociation de la base est faible :
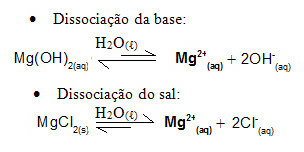
- Ajout d'une petite quantité d'acide fort :
Dans ce cas, les ions H3O+1 provenant de l'ajout d'acide fort sera neutralisé par les ions OH-, provenant d'une faible dissociation des bases. Cela déplacera l'équilibre de dissociation de base vers la droite.
Ainsi, la variation de pH (le cas échéant) sera très faible, car la concentration en ions OH- reste constant. L'effet tampon cessera lorsque toute la base sera dissociée.
- Ajout d'une petite quantité de base forte :
La base forte ajoutée subit une dissociation libérant des ions OH-. L'hydroxyde de magnésium étant une base faible, le magnésium libéré lors de la dissociation du sel aura une plus grande tendance à réagir avec l'OH-:

Par conséquent, l'augmentation des ions OH- est compensé par l'augmentation proportionnelle de Mg(OH)2(aq). En conséquence, le pH ne subit pas de changements majeurs.
Cet effet prend fin lorsque tout le cation magnésium a été consommé.
Par Jennifer Fogaça
Diplômé en Chimie
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
FOGAÇA, Jennifer Rocha Vargas. "Qu'est-ce qu'une solution tampon ?"; École du Brésil. Disponible en: https://brasilescola.uol.com.br/quimica/o-que-uma-solucao-tampao.htm. Consulté le 28 juin 2021.
Chimie

Testez vos connaissances et apprenez-en plus avec cette liste d'exercices résolus sur les équilibres chimiques. Grâce à ce matériel, vous pourrez mieux comprendre comment travailler les constantes d'équilibre (Kp, Kc et Ki), le décalage d'équilibre, le pH et le pOH, ainsi que l'équilibre dans les solutions dites tampons.
Solution, solution solide. Solution liquide, solution gazeuse, solutions formées de gaz et de liquide, solutions formées de liquides.