L'action d'un catalyseur consiste essentiellement à accélérer le développement d'une certaine réaction. Ceci est possible car le catalyseur modifie le mécanisme par lequel la réaction se déroule, conduisant à un « chemin alternatif » qui nécessite moins d'énergie d'activation pour que la réaction démarre et atteigne le complexe activé.
Il existe plusieurs types de catalyse, dont le catalyse hétérogène, qui peut être défini comme celle qui se produit lorsque le système a plus d'une phase, c'est-à-dire que les réactifs et les produits sont dans un état physique différent de l'état physique du catalyseur.
On peut citer comme exemple une étape intermédiaire de formation d'acide sulfurique (H2SEUL4(aq)). Cette étape consiste en la formation de trioxyde de soufre (SO3(g)) par réaction de combustion du dioxyde de soufre (SO2(g)):
2 SO2(g) + O2(g) → 2 OS3(g)
Comme cette réaction se déroule si lentement, un catalyseur est utilisé pour l'accélérer. Un catalyseur utilisable dans ce cas est le pentoxyde de divanadium (V
2O5(S)), qui est solide. Puisque les réactifs et le produit de réaction sont gazeux, nous aurons un système hétérogène.Mais comment le pentoxyde de divanadium peut-il accélérer la réaction ?
En effet, les molécules du réactif oxygène sont adsorbées, c'est-à-dire retenues à la surface du pentoxyde de divanadium. Cela provoque une fragilisation des liaisons des molécules de ce gaz avec le temps, ce qui facilite la formation du complexe activé et, par conséquent, diminue l'énergie d'activation de la réaction, augmentant sa vitesse de développement, c'est-à-dire son rapidité.
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
Voyez comment cela se passe dans le diagramme ci-dessous :
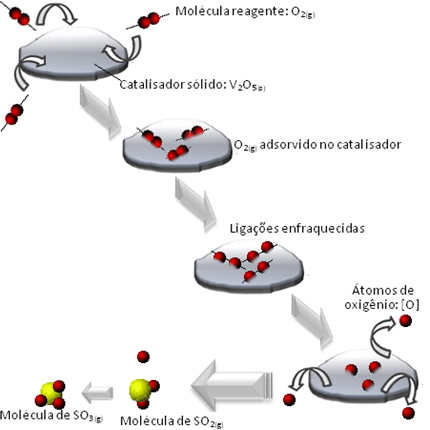
D'autres exemples de catalyse hétérogène sont présentés ci-dessous. A noter que dans les deux cas les réactifs et produits sont à l'état gazeux, aqueux ou liquide, tandis que les catalyseurs sont à l'état solide :
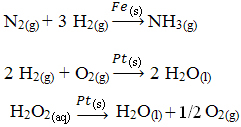
Un exemple de catalyse hétérogène qui se produit dans notre vie quotidienne est celui des convertisseurs catalyseur de voiture, mieux connu comme catalyseurs. Ces dispositifs anti-pollution sont revêtus de substances qui agissent comme des catalyseurs, étant généralement un alliage de palladium et de rhodium (pour les moteurs à essence) et de palladium et de molybdène (pour les moteurs à essence). de l'alcool).
Au sein de ce catalyseur, se produisent des réactions chimiques au cours desquelles les gaz issus d'une combustion incomplète, plus nocifs pour l'homme, sont transformés en gaz non toxiques. Les réactifs et les produits sont tous des gaz, tandis que les catalyseurs sont des solides.
Pour mieux comprendre le système d'exploitation de cet équipement, lisez le texte: "Convertisseur catalytique”.
Par Jennifer Fogaça
Diplômé en Chimie
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
FOGAÇA, Jennifer Rocha Vargas. « Catalyse hétérogène »; École du Brésil. Disponible en: https://brasilescola.uol.com.br/quimica/catalise-heterogenea.htm. Consulté le 27 juin 2021.


