est appelé faisceau d'ions la taille d'un ion. L'étude de cette propriété dépend de la connaissance du rayon atomique et des ions.
Rayon atomique : est une mesure de la taille d'un atome neutre (distance théorique du noyau à la dernière électrosphère).
ions: atomes qui perdent (cations) ou gagnent des électrons (anions).
Les protons à l'intérieur du noyau d'un atome exercer une force d'attraction sur les électrons (particules négatives) présents dans les électrosphères. Plus le nombre de protons est grand, plus cette attraction est grande et vice versa. Lorsque le nombre d'électrons dans un atome est modifié par une perte ou un gain de ces particules, l'attraction entre les protons et les électrons est modifiée comme suit :
Dans le cas d'un cation :
Le nombre d'électrons dans les électrosphères devient inférieur au nombre de protons à l'intérieur du noyau, le ce qui augmente la force d'attraction du noyau, rapprochant les électrons de celui-ci. électrosphères. Le résultat est une diminution du rayon de l'atome. Ainsi, le rayon d'un cation sera toujours plus petit que le rayon de son atome neutre.
Rayon de l'atome neutre > Rayon du cation
Dans le cas d'un anion :
Le nombre d'électrons dans les électrosphères devient supérieur au nombre de protons à l'intérieur du noyau. Dans ce cas, la force d'attraction exercée par le noyau est surmontée par la force de répulsion entre les électrons présents dans les électrosphères, ce qui entraîne une augmentation du rayon de l'atome. Ainsi, le rayon d'un anion sera toujours supérieur au rayon de son atome neutre.
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
Rayon de l'anion > Rayon de l'atome neutre
Les deux situations présentées ci-dessous sont un bon exemple de ce qui arrive au rayon d'un ion :
1er) atome de sodium neutre (11Na) et le cation Sodium (11À+)
Alors que l'atome de sodium neutre a onze protons (sphères jaunes) et onze électrons (sphères rouges), le cation sodium a onze protons et dix électrons.

Modèle d'atome neutre en sodium
Lorsque l'atome de sodium neutre perd un électron, le rayon diminue.
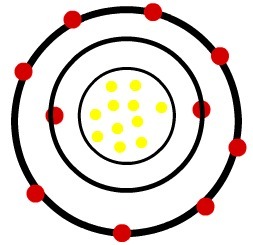
Modèle d'un cation sodium
Observation: Le troisième niveau n'était pas représenté dans l'image du cation car, comme il a perdu le seul électron qu'il possédait, il est devenu vide et, par conséquent, a été ignoré, mais il est présent.
2e) atome neutre de phosphore (15P) et le cation phosphore (15P-3)
Alors que l'atome de phosphore neutre possède quinze protons (sphères jaunes) et quinze électrons (sphères rouges), l'anion phosphore possède quinze protons et dix-huit électrons.
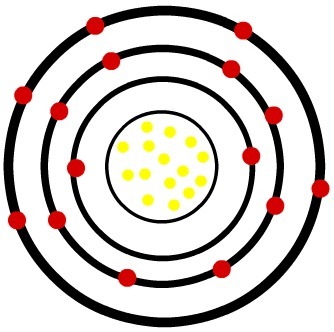
Modèle d'un atome de phosphore neutre
Lorsque l'atome de phosphore neutre gagne trois électrons, le rayon augmente.
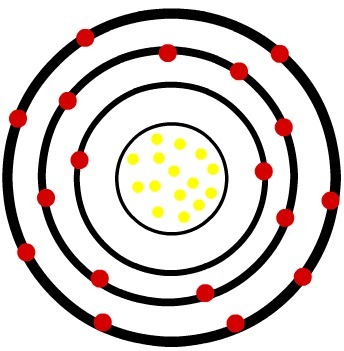
Modèle d'un anion du phosphore
Par moi Diogo Lopes Dias
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
JOURS, Diogo Lopes. "Rayon ionique"; École du Brésil. Disponible en: https://brasilescola.uol.com.br/quimica/raio-ionico.htm. Consulté le 28 juin 2021.



