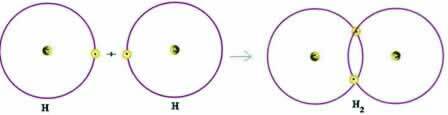
Parmi les complexités de l'étude atomique se trouve la détermination de la taille de l'atome ou, mieux, la rayon atomique. Cette propriété périodique décrit la distance entre le noyau et l'électron le plus externe de ses niveaux électroniques. Pour le déterminer, une moyenne arithmétique de la distance entre les noyaux de deux atomes qui forment une substance simple, par exemple, est effectuée.

Représentation de la distance entre deux noyaux atomiques
Déterminons le rayon atomique (RA) des atomes illustrés dans l'image. Pour cela, il suffit de diviser la distance entre les noyaux par 2 :
RA = ré
2
O étude des rayons atomiques est important car il favorise la compréhension de certains événements physiques (densité, point de fusion, point d'ébullition et énergie d'ionisation) et les produits chimiques (liaisons chimiques) qui se produisent avec atomes.
En analysant un tableau périodique, nous pouvons évaluer si un atome est plus grand ou plus petit par rapport à un autre, et ainsi déterminer s'il a plus ou moins de facilité à retirer un ou plusieurs électrons de leurs orbitales. LES
évaluation et détermination du rayon atomique dans le tableau périodique s'effectue selon deux critères fondamentaux :a) Nombre de niveaux d'énergie (familles ou groupes/colonnes verticales)
Nous savons que les atomes peuvent avoir jusqu'à sept niveaux d'énergie (K, L, M, N, O, P, Q) et que chacun élément chimique se situe en familles ou en groupes (colonnes verticales) et en périodes (colonnes horizontal). Les périodes indiquent le nombre de niveaux de l'atome d'élément et la famille indique le sous-niveau le plus énergétique de l'atome. Dans un groupe ou une famille, les éléments chimiques diffèrent par la quantité de niveaux d'énergie. Voir le tableau ci-dessous :

Plus le nombre de niveaux d'énergie d'un atome est grand, plus son rayon atomique est grand. En analysant le tableau ci-dessus, on peut voir que le francium a le plus gros atome car il a sept niveaux. L'atome de potassium, en revanche, a un rayon plus petit car il a quatre niveaux d'énergie. Ce qui suit est une représentation comparative entre l'atome de francium et l'atome de potassium :

Représentation des sept niveaux d'énergie de l'atome de Francium
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)

Représentation des quatre niveaux d'énergie de l'atome de potassium
Le diagramme suivant représente comment l'augmentation du rayon atomique se produit dans la même famille ou groupe (colonnes verticales) du tableau périodique. Plus le nombre de niveaux est grand, plus le rayon est grand, c'est-à-dire sur le tableau périodique, le rayon atomique croît de haut en bas :

Représentation de la façon dont le rayon atomique augmente dans une famille de tableau périodique
b) Numéro atomique (Z ou nombre de protons) dans la même période (colonne horizontale)
Lorsque des éléments chimiques appartiennent à la même période, leurs atomes ont la même quantité de niveaux d'énergie, mais la quantité de protons à l'intérieur de leurs noyaux est différente. Voici une séquence d'éléments appartenant à la quatrième période du tableau périodique :

Tous les atomes des éléments représentés dans le tableau ci-dessus ont quatre niveaux d'énergie, mais chacun d'eux a une quantité différente de protons dans son noyau. Comme les protons à l'intérieur du noyau exercent une force d'attraction sur les électrons présents dans les niveaux d'énergie, plus la quantité de protons dans le noyau est grande, plus leur attraction vers les électrons est grande. Le résultat est une approximation des niveaux vers le noyau, diminuant la taille de l'atome.
↑Z = ↓Rayon atomique
↓Z = ↑Rayon atomique
Ainsi, nous pouvons affirmer que le rayon atomique de l'élément potassium est supérieur à celui du vanadium en raison du plus petit nombre de protons.
Le diagramme suivant représente l'augmentation du rayon atomique au cours de la même période (ligne horizontale). Plus le numéro atomique est petit, plus le rayon est grand, c'est-à-dire que le rayon atomique dans le tableau augmente de droite à gauche

Représentation de la façon dont le rayon atomique augmente dans une période du tableau périodique
Par moi Diogo Lopes Dia
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
JOURS, Diogo Lopes. "Rayon atomique"; École du Brésil. Disponible en: https://brasilescola.uol.com.br/quimica/raio-atomico.htm. Consulté le 28 juin 2021.