À des liaisons covalentes, aussi appelé liaisons moléculaires ou homopolaires, sont ceux qui se produisent entre les atomes de éléments électronégatifs, c'est-à-dire avec une tendance à recevoir des électrons, établissant une liaison de partageant les électrons de leurs couches de valence.
Une liaison covalente peut se produire entre les éléments suivants: l'hydrogène, les non-métaux et les semi-métaux. Les métaux ne participent jamais à ce type de liaison.
Considérons un exemple simple de liaison covalente: la liaison hydrogène gazogène (H2):
H + H → H2
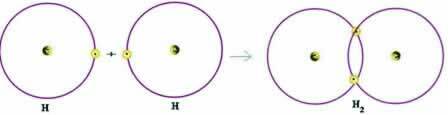
Notez que les deux atomes devaient recevoir un électron pour compléter leur couche de valence - selon la règle de l'octet - et, de cette manière, rester stables. Par conséquent, ils partageaient leurs électrons et, de cette manière, ils avaient tous les deux deux électrons, avaient leur couche K complète et avaient acquis la configuration de l'hélium, un gaz noble.
Ce partage d'électrons est ce qui différencie ce type de liaison de la liaison ionique, dans laquelle le transfert d'électrons a lieu.
Voir la figure ci-dessous pour deux autres exemples de ce cas :
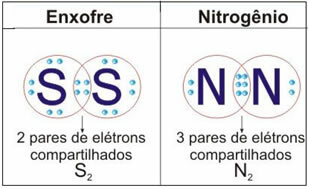
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
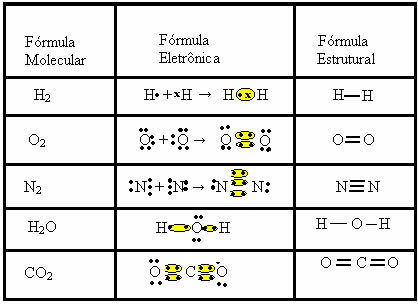
Dans ce type de liaison, il y a la formation de molécules, qui peuvent être représentées par leurs formules moléculaires, c'est-à-dire la représentation la plus simple qui indique le nombre d'atomes de chaque élément dans la molécule. Voici quelques exemples de formules moléculaires: H2, S2, ô2, non2, H2O, CO2, etc.
La liaison covalente peut être représentée par deux autres formules :
- Formule électronique ou formule de Lewis: dans cette formule apparaissent également les électrons de la couche de valence de chaque atome et la formation de paires électroniques. Ces électrons sont symbolisés par les signes . ou x ;
- Formule structurelle plate ou formule structurelle Couper: montre les liens des éléments, chaque paire partagée correspondant à un tiret. S'il ne s'agit que d'un tiret, nous l'appelons un lien unique; s'il y en a deux, double liaison; et s'il y a trois tirets, triple liaison.
Regardez d'autres exemples de liaisons covalentes représentées par ces trois formules chimiques :
Par Jennifer Fogaça
Diplômé en Chimie
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
FOGAÇA, Jennifer Rocha Vargas. "Des liaisons covalentes"; École du Brésil. Disponible en: https://brasilescola.uol.com.br/quimica/ligacoes-covalentes.htm. Consulté le 27 juin 2021.



