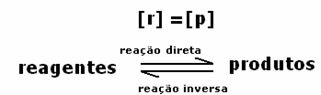
L'équilibre dynamique ou l'équilibre chimique d'une réaction se produit lorsque les réactions directes et inverses se produisent simultanément. Ces systèmes dits réversibles sont représentés par des flèches dans les deux sens:  ou alors
ou alors  . Un exemple de réaction réversible est cité dans l'image ci-dessus, entre l'iode gazeux et l'hydrogène gazeux.
. Un exemple de réaction réversible est cité dans l'image ci-dessus, entre l'iode gazeux et l'hydrogène gazeux.
Au début de la réaction, la quantité de réactifs est maximale et celle de produits est nulle. Cependant, les réactifs réagissent entre eux, diminuant leur concentration et augmentant celles des produits formés. La vitesse de développement de la réaction directe diminue également.
Au fur et à mesure que la concentration des produits augmente, la réaction inverse démarre et les réactifs se forment à nouveau; la vitesse de développement de la réaction inverse augmente également.
Une fois l'équilibre chimique atteint, à température constante, les vitesses de développement des réactions directes et inverses sont égales.
Toutdirect = Tout inverse
Les taux sont les mêmes, mais les concentrations ne le sont pas. Il est peu probable que les concentrations de réactifs et de produits soient les mêmes. Ce n'est que dans de rares cas que cela se produit. Dans la plupart des cas, la concentration des réactifs sera supérieure à celle des produits ou vice versa.
Ainsi, nous avons trois manières possibles de représenter graphiquement les taux de développement de réactions directes et inverses, reliant les concentrations de réactifs et de produits au cours de la temps. Regardons chaque cas :
1er cas: Concentrations égales :
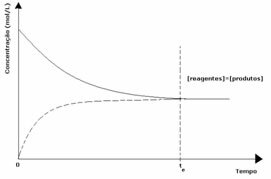
Comme on le voit sur le graphique, au temps tet les réactions directes et inverses sont les mêmes, auquel cas les concentrations de réactifs et de produits sont les mêmes. Ainsi, l'équilibre n'est pas déplacé d'un côté ou de l'autre, l'intensité des deux réactions est la même, comme exprimé ci-dessous :
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
2ème cas: Concentration des réactifs supérieure à la concentration des produits :
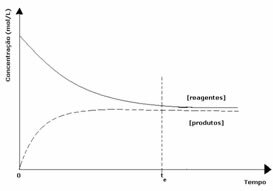
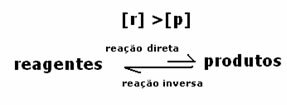
Dans ce cas, on observe qu'à l'équilibre, la concentration des réactifs est supérieure à celle des produits. Ainsi, il est conclu que s'il y a plus de réactif, la réaction inverse se produit avec une plus grande intensité. La réaction est décalée vers la gauche :
3ème cas: Concentration des produits supérieure à celle des réactifs :
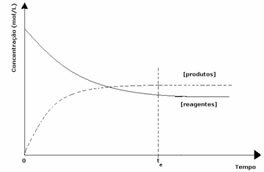
Etant donné qu'à l'équilibre la concentration des produits est plus élevée, cela signifie que la réaction est décalée vers la droite, car la réaction directe (avec formation de produits) se produit avec une plus grande intensité.
Ce qui indiquera si la réaction tend vers la droite ou vers la gauche sera la constante d'équilibre K, qui ne dépend que de la température.
Par Jennifer Fogaça
Diplômé en Chimie
Équipe scolaire du Brésil
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
FOGAÇA, Jennifer Rocha Vargas. « Étude graphique de l'équilibre chimique »; École du Brésil. Disponible en: https://brasilescola.uol.com.br/quimica/estudo-grafico-equilibrio-quimico.htm. Consulté le 28 juin 2021.
Chimie

Testez vos connaissances et apprenez-en plus avec cette liste d'exercices résolus sur les équilibres chimiques. Grâce à ce matériel, vous pourrez mieux comprendre comment travailler les constantes d'équilibre (Kp, Kc et Ki), le décalage d'équilibre, le pH et le pOH, ainsi que l'équilibre dans les solutions dites tampons.


