Le chimiste américain Gilbert N. Lewis (1875-1946) a proposé la règle de l'octet, qui dit :
"Les atomes de différents éléments établissent des liaisons chimiques, donnant, recevant ou partageant des électrons, afin d'acquérir la configuration électronique de gaz noble, c'est-à-dire avec 8 électrons dans la dernière couche (ou avec 2 électrons dans le cas des atomes qui n'ont qu'une seule couche électronique, comme cela se produit avec le hydrogène)."
En 1916, Lewis suggéra que pour rester stables, atteignant l'octet ou le duo, les éléments qui composent le substances moléculaires effectuer un partage de paires d'électrons. Ces substances ne sont formées que d'atomes de hydrogène, non-métaux et semi-métaux, le tout avec le tendance à recevoir des électrons. Par conséquent, il n'y a aucun moyen pour aucun d'entre eux de donner un électron (comme cela se produit avec les métaux dans les liaisons ioniques), mais tout le monde a besoin de recevoir, donc ils partagent leurs électrons via une liaison covalente ou moléculaire.
Ainsi, Gilbert Lewis a proposé un moyen de représenter la liaison covalente ou moléculaire, connue sous le nom de formule de Lewis. Elle s'appelle aussi formule électronique ou encore, Formule électronique de Lewis, car sa principale caractéristique est qu'il montre les électrons dans la couche de valence de chaque atome et la formation de paires électroniques.
Chaque électron est représenté par un point., qui entoure le symbole de l'élément chimique correspondant. Seuls les électrons de la couche de valence sont autour de l'élément.
Comme le montre le tableau ci-dessous, pour connaître la quantité d'électrons dans la couche de valence, il suffit de connaître la famille du tableau périodique :
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)

Dans la formule de Lewis, chaque paire d'électrons partagée représente une liaison chimique (covalente), où les électrons se rencontrent dans la région de l'électrosphère qui est commune à chaque paire d'atomes qui sont réunis. Par conséquent, dans la représentation, ils sont placés côte à côte.
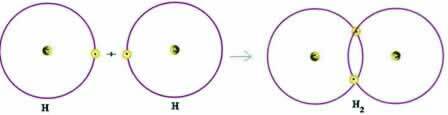
Par exemple, découvrons quelle est la formule de Lewis pour l'hydrogène gazeux, dont la formule moléculaire est: H2.
Chaque atome d'hydrogène n'a qu'un seul électron dans la couche de valence, car cet élément appartient à la famille 1 du tableau périodique. Chacun doit recevoir un électron de plus, pour être stable, avec deux électrons dans la couche d'électrons K. Alors ils partagent leurs électrons et tous les deux en reçoivent deux. Voir:
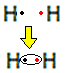
C'est la formule de Lewis pour la molécule d'hydrogène gazeux.
L'oxygène a six électrons dans sa couche électronique, donc chacun doit recevoir deux électrons supplémentaires pour être stable, avec huit électrons. Par conséquent, la formule de Lewis pour la molécule d'oxygène gazeux est :

Voir qu'il y a deux liens, comme il y a deux paires partagées.
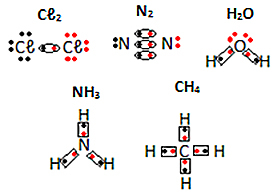
Voir d'autres exemples de formules électroniques de substances moléculaires ci-dessous :
Par Jennifer Fogaça
Diplômé en Chimie
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
FOGAÇA, Jennifer Rocha Vargas. « Formule électronique de Lewis »; École du Brésil. Disponible en: https://brasilescola.uol.com.br/quimica/formula-eletronica-lewis.htm. Consulté le 28 juin 2021.
Formule spatiale du carbone, formule électronique de Lewis, structure plane, paires électroniques, liaison covalent, couche de valence, évolution du modèle atomique, formule moléculaire, formule développée, formules tridimensionnel.
Formules chimiques, formule structurelle plate, formule structurelle Couper, triple liaison, gaz azote, formule électronique, formule de Lewis, formule moléculaire, liaison simple, double liaison, gaz carbonique.
Chimie
Substances moléculaires, température d'ébullition, surface de contact, point d'ébullition, forces d'attraction intermoléculaires, liaison chimique, composés moléculaires, liaisons chimiques covalentes, liaisons ioniques, liaisons métalliques, états physiques de mal