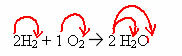O acide sulfurique c'est un liquide incolore, visqueux, peu volatil (température d'ébullition: 338°C) et extrêmement soluble dans l'eau. Et le substance la plus utilisée par les industries, ayant une large application dans les processus les plus variés.
A lire aussi: qu'est-ce que la solubilité?
Formule
O acide sulfurique est un composé inorganique et covalent avec formule moléculaireH2SEUL4. Lorsqu'il est ajouté à l'eau, il libère le cation H+ et l'anion sulfate (SO42-), selon l'équation chimique suivante :
H2SEUL4(aq) → 2 heures+(ici) + système d'exploitation42-(ici)
Cette dissolution est très exothermique, c'est-à-dire qu'il dégage une grande quantité de chaleur et nécessite donc un certain soin pendant le processus. Pour éviter les accidents, on met toujours de l'acide sulfurique dans l'eau, et jamais l'inverse, afin que la chaleur dégagée puisse être dissipée avec une plus grande sécurité.
Voir aussi: Chimie inorganique

applications
La plupart de l'acide sulfurique produit dans le monde est utilisé pour
fabrication d'engrais phosphatés et sulfatés. Pour cette application et d'autres, l'acide sulfurique est devenu la substance la plus utilisée par les industries et peut être considéré comme un indice pour évaluer le développement industriel d'un pays.
L'acide sulfurique est également largement utilisé dans fabrication de sulfate d'aluminium, l'un des produits nécessaires à la fabrication de papier. Ce processus se déroule par la réaction entre l'acide sulfurique et l'oxyde de aluminium présent dans le minerai de bauxite :
3 heures2SEUL4 + Al2O3 → Al2(SEUL4)3 + 3H2O
L'acide sulfurique est également présent dans batteries au plomb utilisées dans les voitures, agissant comme électrolyte dans le processus de fabrication de électricité.
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
Savoir plus: Engrais organiques et inorganiques
Comme mentionné, l'acide sulfurique a de nombreuses applications. En plus de ceux mentionnés, nous en énumérerons d'autres ci-dessous :
- Affiner le Pétrole;
- Fabrication de nylon;
- Préparation de surface des métaux dans les industries métallurgiques ;
- Catalyseur acide dans réactions chimiques;
- Fabrication d'explosifs ;
- Traitement des eaux usées;
- Déboucher les canalisations (dans certains cas).
A lire aussi: Les nitrates, sels très présents dans les explosifs et les engrais
où se trouve-t-il
En raison de sa haute solubilité dans l'eau, l'acide sulfurique ne se trouve pas naturellement sous sa forme pure. Sous forme diluée, on le trouve dans pluie acide est sur cours d'eau d'origine minérale, généralement de sulfure de fer.
Dans l'industrie, l'acide sulfurique est produit à base de soufre élémentaire, par une méthode appelée processus de contact, ce qui se passe dans trois étapes:
1ère étape: brûler du soufre pour produire du dioxyde de soufre.
s(s) + O2(g) → SE2(g)
2ème étape: oxydation du dioxyde de soufre en trioxyde de soufre.
2 SO2(g) + O2(g) → 2 OS3(g)
3ème étape: le trioxyde de soufre formé est hydraté, formant de l'acide sulfurique.
SEUL3(g) + H2O(1) → H2SEUL4(1)
Voir aussi: qu'est-ce que les pluies acides?
Par Victor Ferreira
Professeur de chimie
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
FERREIRA, Victor Ricardo. « Utilisation de l'acide sulfurique par l'industrie »; École du Brésil. Disponible en: https://brasilescola.uol.com.br/quimica/uso-Acido-sulfurico-pela-industria.htm. Consulté le 28 juin 2021.