Les réactions de une addition sont des actions importantes en matière de synthèses organiques, car à travers elles un nombre intéressant de substances organiques peuvent être développées.
Pour que la réaction d'addition se produise, il est nécessaire de créer deux sites de liaison dans la chaîne carbonée, ce qui se produit simplement lorsque la chaîne est insaturée (présence de lien pi). Ainsi, lorsque le lien pi est rompu, les sites apparaissent dans la chaîne.
Un groupe de substances qui peuvent être utilisées en plus des synthèses sont cycloalcanes ou cyclane, groupe d'hydrocarbures à chaînes cycliques et saturées. Ils échappent à la règle générale de l'addition car ils n'ont pas de lien pi, mais selon certaines conditions (chaleur, métal catalyseur, milieu acide) ils peuvent subir une rupture de chaîne entre deux atomes de carbone, provoquant l'apparition de deux sites de liaison pour que l'addition ait lieu. Cependant, il existe un fait qui limite l'utilisation de ces composés. Le fait est l'appel théorie de la contrainte annulaire, proposée par Adolf V. Bayer en 1885.
Pour que la liaison sigma entre les carbones soit rompue, il doit y avoir une certaine instabilité entre les carbones. Cette instabilité est liée à l'angle des liaisons entre les carbones. Selon Bayer, l'angle qui fournit un grande stabilité pour le lien sigma est de 109,47O. Ainsi, les chaînes qui ont un angle entre les carbones inférieur à 109,47O ils ont tendance à avoir une instabilité dans les liaisons sigma entre les carbones qui forment les chaînes, ce qui favorise leur rupture alliée à une condition extérieure idéale.
Les seuls cycloalcanes qui ont un angle inférieur à 109,47O parmi ses carbones se trouvent cyclopropane (60O), cyclobutane (90O) et le cyclopentane (108O). Le cyclopentane a un angle très proche de 109,47O il a des liaisons sigma très stables, il ne peut donc subir aucune réaction d'addition. Ci-dessous, nous avons les structures de ces trois cycloalcanes :

Formule développée du cyclopropane, du cyclobutane et du cyclopentane, respectivement
Observation: Tout cycloalcane qui a plus de 5 carbones dans la chaîne effectuera une réaction de substitution pour exemple, et jamais une addition car les liaisons sigma entre leurs atomes de carbone sont extrêmement stable.
Les réactions d'addition qui peuvent se produire avec les cycloalcanes sont fondamentalement toutes, mais avec le cyclopentane, les seules qu'il peut subir sont l'hydrogénation et l'halogénation. Voici des exemples d'ajouts avec des cycloalcanes et leurs conditions d'occurrence :
a) Hydrogénation
Réaction du cycloalcane avec la molécule d'hydrogène avec présence de catalyseur métallique en poudre (zinc, nickel ou platine) en présence de chauffage (environ 180°COÇ). Dans cette réaction, le cycloalcane donnera naissance à un hydrocarbure. Dans cette réaction, après la rupture du cycle, un atome d'hydrogène est ajouté à chacun des carbones de la liaison sigma qui a été rompue.
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)

Réaction d'addition dans le cyclobutane à l'aide d'hydrogène
b) Halogénation
Réaction du cycloalcane avec la molécule d'halogène (chlore, brome, iode par exemple) avec la présence de catalyseur chlorure de fer III (FeCl3). Dans cette réaction, le cycloalcane donnera naissance à un halogénure organique avec deux atomes d'halogène dans la chaîne. Une fois le cycle rompu, nous avons ajouté un atome d'halogène sur chacun des carbones de la liaison sigma qui a été rompue.

Réaction d'addition dans le cyclobutane à l'aide de brome
c) Réaction avec des hydrures halogénés (halogénures d'acide)
Réaction du cycloalcane avec la molécule d'hydrate inorganique halogéné (HCl. HBr, HI). Comme un acide est utilisé comme réactif, un catalyseur n'est pas utilisé. Dans cette réaction, le cycloalcane donnera naissance à un halogénure organique avec un seul atome d'halogène dans la chaîne. Une fois le cycle rompu, nous avons ajouté un atome d'hydrogène sur l'un des carbones de la liaison sigma qui a été rompue et un halogène sur l'autre carbone. Obéissant à la règle de Markovnikov (H sur le carbone le plus hydrogéné et halogène sur le carbone le moins hydrogéné).
Remarque: Cela ne se produit qu'avec le cyclopropane et le cyclobutane.
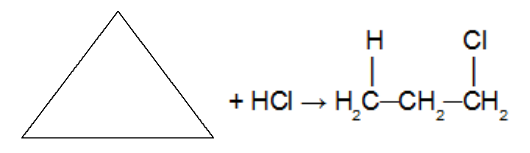
Réaction d'addition dans le cyclopropane à l'aide d'acide chlorhydrique
Remarque: Cela ne se produit qu'avec le cyclopropane et le cyclobutane.
d) Hydratation
Réaction du cycloalcane avec une molécule d'eau en présence d'acide sulfurique et chauffage. Dans cette réaction, le cycloalcane donnera naissance à un monoalcool (alcool avec un seul groupe OH dans la chaîne). Une fois le cycle rompu, nous avons ajouté un atome d'hydrogène sur l'un des carbones de la liaison sigma qui a été rompue et un hydroxyle (OH) sur l'autre carbone. Obéir à la règle de Markovnikov (H sur le carbone le plus hydrogéné et hydroxyle sur le carbone le moins hydrogéné).
Remarque: Cela ne se produit qu'avec le cyclopropane et le cyclobutane.

Réaction d'addition dans le cyclopropane à l'aide d'acide chlorhydrique
Par moi Diogo Lopes Dias
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
JOURS, Diogo Lopes. "Ajouts dans les cyclanes"; École du Brésil. Disponible en: https://brasilescola.uol.com.br/quimica/adicoes-ciclanos.htm. Consulté le 27 juillet 2021.
Chimie

Fonction hydroxyle, Alcools primaires, Alcools secondaires, Alcools tertiaires, Méthanol, Glycérol, Ethanol, préparation de nitroglycérine, fabrication de peinture, production de boissons alcoolisées, acide acétique, carburant automobiles.



