La grande majorité des matériaux trouvés dans la nature, dans notre société et dans notre corps ne sont pas des substances pures, mais, en fait, mélanges de deux ou plus substances.
Bien que l'on se réfère, la plupart du temps, à l'eau minérale uniquement comme « eau », en réalité elle ne contient pas seulement la substance pure H2O, parce qu'elle est le résultat d'un processus au cours duquel l'eau de pluie pénètre dans le sol et traverse diverses roches.
Ainsi, comme son nom l'indique, en plus de l'eau, il contient également plusieurs minéraux dissous. Si vous êtes curieux de vérifier l'étiquette d'une eau minérale, vous verrez qu'elle a dans sa composition chimie sulfates de strontium, calcium, sodium, potassium, bicarbonate de sodium, fluorure de sodium, parmi autres.
Carte mentale: Mélanges
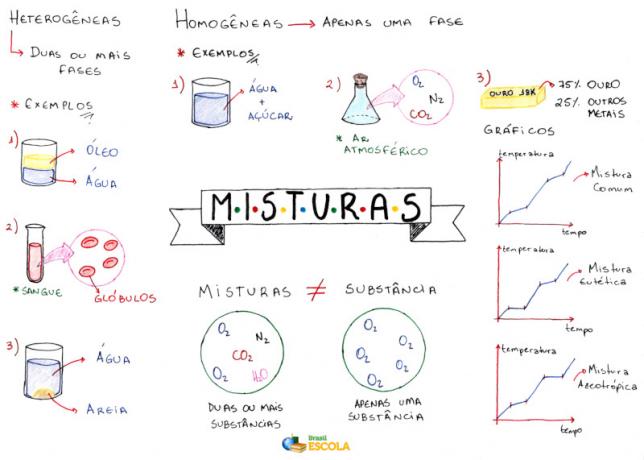
* Pour télécharger la carte mentale en PDF, Cliquez ici!
Comment différencier une substance d'un mélange ?
L'eau distillée ci-dessous est une substance pure qui ne contient que H2O :

Eau distillée utilisée en laboratoire
Visuellement, cela ressemble exactement à un mélange d'eau et de sel; cependant, ils peuvent être différenciés de la définition du mélange. Voir:
→ Mélanges sont des matériaux dont les propriétés physiques ne sont pas constantes, mais varient à une certaine température et pression.
Alors, il suffit de mesurer le propriétés physiques, tels que les points de fusion et d'ébullition et la densité. S'ils sont constants et bien définis, c'est un substance pure (dans le cas de l'eau distillée, à 4°C, sa densité est de 1,0 g/cm3 et, au niveau de la mer, les points de fusion et d'ébullition sont respectivement de 0°C et 100°C).
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
Cependant, si des variations sont présentées, il s'agit d'un mélange. Si vous chauffez le mélange eau-sel pour vérifier le point d'ébullition, vous verrez que lors du passage de l'état liquide à gaz, la température ne reste pas constante, comme pour l'eau distillée, qui reste à 100 °C jusqu'à ce que tout le liquide se transforme vapeur.
Maintenant il y a mélanges qu'il n'est même pas nécessaire de déterminer leurs propriétés physiques pour savoir qu'il s'agit de mélanges, il suffit de regarder, comme c'est le cas avec le mélange d'eau et d'huile suivant :

Mélange formé d'eau et d'huile
Cela indique qu'il existe différents types de mélanges, qui peuvent être classés en homogène et hétérogène. Voir chacun :
Mélanges homogènes :
Ce sont ceux qui ont un aspect uniforme, avec une seule phase (monophasé). Exemples:
solution saline (0,9 g de chlorure de sodium dans 100 ml d'eau);
saumure (36 g de sels tels que chlorure de sodium, chlorure de magnésium, iodate de potassium, anti-humectants et 100 ml d'eau) ;
alcool hydraté (éthanol et eau);
air (78 % d'azote gazeux, 20 % d'oxygène gazeux, 2 % d'autres gaz et vapeur d'eau) ;
acier (alliage métallique formé de 98,5% de fer et 1,5% de carbone).

Solution saline, acier et formaldéhyde, exemples de mélanges homogènes
Les exemples ci-dessus montrent que mélanges homogènes ils peuvent être à l'état solide, liquide ou gazeux. Ces mélanges homogènes sont appelés solutions et ils ne peuvent pas être séparés par des méthodes physiques, mais seulement par des techniques chimiques. Pour séparer l'alcool de l'eau, par exemple, il est nécessaire d'effectuer un processus de distillation, parce qu'un centrifuger ou alors filtration ça ne ferait pas.
De plus, il est important de souligner qu'ils doivent être homogène même en regardant sous un ultramicroscope. À l'œil nu, le lait et le sang, par exemple, peuvent sembler homogènes, mais à l'ultramicroscope, nous voyons qu'ils sont en fait hétérogène. Voir l'image du sang sous l'ultramicroscope et ses phases séparées après qu'il a été placé dans une ultracentrifugeuse :
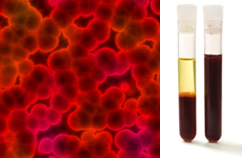
Image microscopique et phases sanguines
Mélanges hétérogènes :
Sont ceux qui ont plus d'une phase. Exemples: eau et huile, eau et sable, glace et eau, granit, eau et fer, sel non dissous dans l'eau, etc.
Les composants de mélanges hétérogènes ils apparaissent, dans la plupart des cas, dans des états physiques différents et peuvent être séparés par des méthodes physiques. Un exemple se produit lorsque nous préparons du café et filtrons le solide en le séparant du liquide.
Mais cela ne se produit pas toujours, comme le montre le cas de l'huile et de l'eau, qui, bien qu'étant toutes deux liquides, ne se dissolvent pas en raison de différences polarités de ses molécules.
Carte mentale Par Mère Victor Ricardo Ferreira
Professeur de chimie
Par Jennifer Fogaça
Diplômé en Chimie

