isomère géométrique Est une sorte de isomérie spatiale qui évalue et compare la position dans l'espace des ligands de deux atomes de carbone dans une chaîne. Cette évaluation est faite à partir d'un plan imaginaire entre les carbones impliqués.
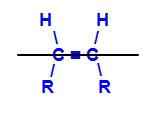
Plan imaginaire divisant la molécule
Le plan imaginaire dans la structure ci-dessus divise la molécule en un plan supérieur et un plan inférieur. Grâce à cela, nous pouvons évaluer et comparer les ligands carbonés impliqués dans chacun de ces plans. Voir les types d'isomères géométriques :
→ Isomère géométrique cis-trans
Un composé a isomérie géométrique cis-trans lorsque la chaîne affiche :
Chaîne ouverte avec une double liaison entre deux carbones, qui ont les mêmes lieurs entre eux. Voir un exemple :
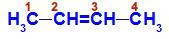
Formule développée du But-2-ène
Dans la structure, nous pouvons observer que le carbone 2 et le carbone 3 ont les mêmes ligands, qui sont l'hydrogène (H) et le méthyle (CH3).
Chaîne fermée avec deux carbones qui ont les mêmes ligands. Voir un exemple :
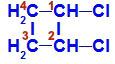
Formule développée du 1,2-dichloro-cyclobutane
Dans la structure, nous pouvons observer que le carbone 1 et le carbone 2 ont les mêmes ligands, qui sont l'hydrogène (H) et le chlore (Cl).
Pour expliquer l'isomérie cis-trans, nous utiliserons le but-2-ène :
a) Isomère cis: est l'isomère géométrique dans lequel les mêmes ligands occupent le même plan. Dans l'exemple ci-dessous, les hydrogènes sont sur le même plan, de même que les radicaux méthyle.

Formule développée du cis-but-2-ène
b) Isomère trans : est l'isomère géométrique dans lequel différents ligands occupent le même plan. Dans l'exemple ci-dessous, nous avons sur le même plan un hydrogène et un méthyle (CH3).
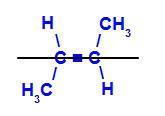
Formule développée du trans but-2-ène
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
→ Isomère géométrique E-Z
Un composé a une isomérie géométrique E-Z lorsque la chaîne a :
Chaîne ouverte avec une double liaison entre deux carbones, qui ont tout ou partie des lieurs différents. Voir un exemple :
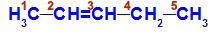
Formule développée du pent-2-ène
Dans la structure, on peut voir que le carbone 2 a le ligand méthyle (CH3) et l'hydrogène (H), et le carbone 3 a le ligand hydrogène (H) et éthyle (H)3C-CH2).
Chaîne fermée avec deux carbones qui ont tout ou certains ligands différents les uns des autres. Voir un exemple :
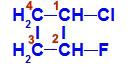
Formule développée du 1-chloro-2-fluoro-cyclobutane
Dans la structure, nous pouvons observer que le carbone 1 a de l'hydrogène et du chlore comme ligands principaux, et que le carbone 2 a de l'hydrogène et du fluor comme ligands principaux.
REMARQUE: Parmi les différents ligands, en isomérie géométrique, on évalue la complexité du ligand (nombre d'atomes) ou le numéro atomique.
Pour expliquer l'isomère E-Z, nous utiliserons à la fois le pent-2-ène et le 1-chloro-2-fluoro-cyclobutane :
a) E-isomère
isomère géométrique où les ligands les plus complexes ou ceux ayant le numéro atomique le plus élevé sont positionnés sur des plans opposés. Dans l'exemple suivant, le ligand le plus complexe sur le carbone 2 est le méthyle, et le ligand le plus complexe sur le carbone 3 est l'éthyle, qui sont positionnés sur des plans différents.
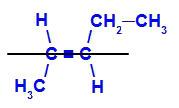
Formule développée de l'E-pent-2-ène
b) Isomère Z
isomère géométrique où les ligands les plus complexes ou ceux ayant le numéro atomique le plus élevé sont positionnés sur le même plan. Dans l'exemple suivant, le ligand de numéro atomique le plus élevé du carbone 1 est le chlore (Z = 17), et le ligand de numéro atomique le plus élevé du carbone 2 est le fluor (Z = 9), qui sont positionnés dans le même plan.
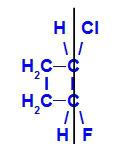
Formule développée du Z-1-chloro-2-fluoro-cyclobutane
Par moi Diogo Lopes Dias
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
JOURS, Diogo Lopes. « Qu'est-ce que l'isomérie géométrique? »; École du Brésil. Disponible en: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-isomeria-geometrica.htm. Consulté le 28 juin 2021.
Chimie
Connaître les différents types d'isomères plans et spatiaux, tels que la fonction, la position, la chaîne, la tautomérie, le métamérisme, l'isomérie géométrique cis-trans et optique.