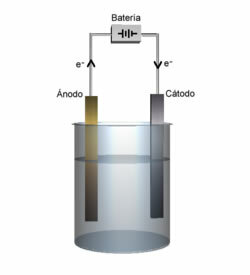
Les piles, ou piles électrochimiques, et les batteries sont des dispositifs dans lesquels l'énergie chimique est spontanément transformée en énergie électrique.La cellule est composée de seulement deux électrodes et d'un électrolyte, tandis que la batterie est un ensemble de batteries en série ou en parallèle.
À les batteries primaires sont des appareils non rechargeables, étant que lorsque la réaction d'oxydoréduction qui s'y déroule cesse, ils doivent être jetés.
Pour chaque équipement, un type de batterie est indiqué et, parmi les batteries primaires actuellement utilisées, les principales sont: Piles sèches Leclanché (piles courantes ou piles acides), piles alcalines et piles lithium/dioxyde de manganèse.
Découvrez ce qui les distingue et à quel équipement ils conviennent :
- Cellules Sèches Leclanché :
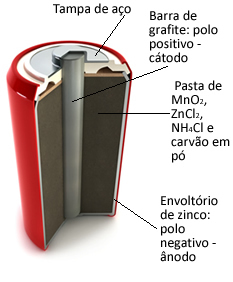
Ces piles sont essentiellement constituées d'une enveloppe de zinc, séparée par un papier poreux et une barre centrale de graphite entourée de dioxyde de manganèse (MnO2), du charbon en poudre (C) et une pâte humide contenant du chlorure d'ammonium (NH
4Cl), chlorure de zinc (ZnCl2) et de l'eau (H2O).O zinc fonctionne comme le anode, perdre des électrons; C'est le graphite fonctionne comme le cathode, conduisant des électrons au dioxyde de manganèse :
Demi-réaction d'anode: Zn (s) → Zn2+(ici) + 2 et-
Semi-réaction cathodique: 2 MnO2(aq) + 2 NH41+(ici) + 2e- → 1Mn2O3(s) + 2NH3(g) + 1 heure2O(1)
Réaction globale: Zn (s) + 2MnO2(aq) + 2 NH41+(ici) → Zn2+(ici) + 1 mn2O3(s) + 2NH3(g)
Ce type de batterie convient aux équipements nécessitant une décharge légère et continue, tels que télécommande, horloge murale, radio portable et jouets.
Vous pouvez obtenir plus de détails sur l'origine, le fonctionnement, la durabilité, la ddp, les dangers et les précautions à prendre avec ces batteries dans le texte "Pile sèche Leclanché”.
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
- Piles alcalines :
Son fonctionnement est très similaire à celui des piles sèches Leclanché, cependant, la seule différence est qu'à la place du chlorure d'ammonium (qui est un sel acide), une base forte est ajoutée, principalement de l'hydroxyde de sodium (NaOH) ou de l'hydroxyde de potassium (KOH).
Demi-réaction d'anode: Zn + 2 OH → ZnO + H2O + 2e-
Semi-réaction cathodique: 2 MnO2 + H2O + 2e-→ Mn2O3 + 2 OH
Réaction globale: Zn +2 MnO2→ ZnO + Mn 2O3

Les piles alcalines sont plus avantageuses que les acides en ce sens qu'elles ont une plus grande durabilité, en fournissent généralement 50 à 100 % plus de puissance qu'une batterie ordinaire de la même taille, et il y a moins de danger de fuites.
Ils sont principalement indiqués pour les appareils qui nécessitent des téléchargements rapides et plus intenses, tels que les radios, les lecteurs CD/DVD et MP3 portables, les lampes de poche, les appareils photo numériques, etc.
Lire aussi le texte Piles alcalines.
- Piles au lithium/dioxyde de manganèse :
Ces batteries sont légères et génèrent une tension élevée (environ 3,4 V), c'est pourquoi elles sont souvent utilisées dans de petits équipements tels que les montres et les calculatrices. Contrairement aux cas précédents, son format est la devise, comme le montre l'image suivante :

L'anode est en lithium, la cathode en dioxyde de manganèse et l'électrolyte est une solution saline :
Demi-réaction d'anode: lis →lis+ + et−
Semi-réaction cathodique: MnO2 + lire+ + et−→MnO2(li)
Réaction globale: Li + MnO2 → MnO2(li)
Par Jennifer Fogaça
Diplômé en Chimie
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
FOGAÇA, Jennifer Rocha Vargas. « Types de piles et de batteries primaires les plus courants »; École du Brésil. Disponible en: https://brasilescola.uol.com.br/quimica/tipos-pilhas-baterias-primarias-mais-comuns.htm. Consulté le 27 juin 2021.