isomères actifs ou les isomères optiquement actifs (IOA) sont des molécules d'une certaine substance chimique qui peuvent effectuer la polarisation et la déviation du plan de lumière droite ou gauche. Pour vérifier si une substance a ou non des isomères actifs, il suffit de vérifier s'il y a un carbone asymétrique dans sa formule structurelle :

En analysant la chaîne représentée dans l'image ci-dessus, nous pouvons voir que le le carbone central a quatre ligands différents (OH, H, CH3 et Cl), ce qui en fait un carbone asymétrique, aussi appelé carbone chiral. Ainsi, chaque fois qu'une chaîne a un ou plusieurs carbones chiraux, il y aura des isomères actifs.
Toi types d'isomères actifs(AIO) elles sont:
Droitier: Isomère optique actif qui courbe la lumière polarisée vers la droite ;
Levogiro : Isomère optique actif qui dévie la lumière polarisée vers la gauche.
Observation: La présence de carbone asymétrique dans une formule développée indique que la substance doit avoir l'isomère lévogyre et l'isomère dextrogyre. Il ne nous appartient pas de savoir dans quel sens la lumière a été déviée, la présence du carbone chiral en atteste déjà. Toujours la moitié des molécules existantes sont gauchers et l'autre moitié est droitière.
Les molécules gauches et droites de toute substance organique ont toujours les mêmes propriétés physiques (point de fusion, point d'ébullition, densité, solubilité etc.), mais présentent des activités chimiques (comportement dans l'organisme) beaucoup de différents. Un exemple est l'adrénaline. Seule la molécule d'adrénaline lévogyre agit dans le corps, contrairement à la dextrogyre.
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
Consultez maintenant la formule développée de la substance butane-2-ol pour vérifier si elle contient ou non des isomères actifs :
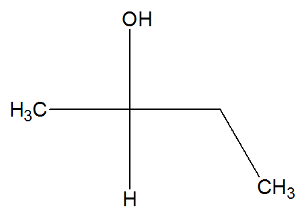
On peut observer, dans la structure du butan-2-ol, que le carbone 2 a quatre classeurs différents (OH, H, CH3, CH2-CH3), c'est donc un carbone chiral et présente un isomère actif dextrogyre et un autre isomère actif lévogyre.
Calcul des isomères actifs (IOA)
Le chimiste hollandais Jacobus Henricus van't Hoff développé une formule qui permet de calculer le nombre d'isomères actifs (IOA) qu'une substance donnée peut présenter. Voir:
IAO: 2non
n: est le nombre de carbones chiraux dans la formule structurelle de la substance.
Suivez deux exemples d'application de la formule Vant't Hoff :
Acide 5-dichloro-2,3-dihydroxy-hexanedioïque

Dans la formule structurelle du composé, il y a trois carbones chiraux ou asymétrique, donc :
IOA = 2non
IOA = 23
IAO = 8
2,3,4,5-tétrahydroxyhexanal

Dans la formule structurelle du composé, il y a quatre carbones chiraux (Flèches rouges) ou asymétrique, donc :
IOA = 2non
IOA = 24
IAO = 16
Observation: Il est possible qu'une formule structurelle ait deux carbones asymétriques qui ont exactement les mêmes ligands. Si cela se produit, nous considérons dans les calculs seulement 1 pour la valeur de n, pas 2. Voir un exemple :
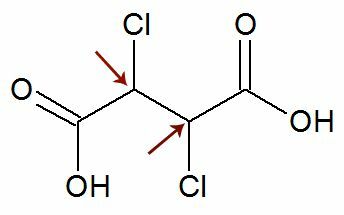
Comme deux carbones chiraux elles sont équivaut à, nous n'en considérons qu'un carbone dans le calcul :
IOA = 2non
IOA = 21
IOA = 2
Par moi Diogo Lopes Dias
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
JOURS, Diogo Lopes. "Isomères actifs"; École du Brésil. Disponible en: https://brasilescola.uol.com.br/quimica/isomeros-ativos.htm. Consulté le 27 juin 2021.


