Imaginez que vous ajoutez 10 g de sel de table (chlorure de sodium - NaCl) dans un verre avec 100 g d'eau à 20ºC. Après avoir mélangé, vous voyez que le sel s'est complètement dissous, vous décidez donc d'ajouter encore plus de sel. À un moment donné, vous ne pourrez plus dissoudre le sel dans cette quantité d'eau, et tout sel ajouté coulera au fond du verre, peu importe à quel point vous essayez de le mélanger.
Lorsque cela se produit, nous disons que la solution est saturé et que le coefficient de solubilité. Par conséquent, nous pouvons définir le coefficient de solubilité comme suit :
“Le coefficient de solubilité est la quantité maximale de soluté qui est solubilisé dans une quantité donnée de solvant, à une température donnée.
Le coefficient de solubilité du sel dans l'eau, par exemple, est égal à 36 g de NaCl/100 g d'eau à 20ºC. Il n'est pas possible de dissoudre un gramme de sel supplémentaire dans cette quantité d'eau et à cette température, car le coefficient de solubilité est spécifique à chaque substance.
Si on change le soluté, par exemple en remplaçant le sel de table par NH4Cl, celui-ci a un coefficient de solubilité égal à 37,2 g dans 100 g d'eau à 20°C.Par ailleurs, la même substance a des solubilités différentes dans différents solvants. Alors que le sel est soluble dans l'eau, il est pratiquement insoluble dans l'acétone ou l'acétate d'éthyle (un solvant utilisé pour éliminer les glaçures).
Un autre point est que chaque fois que le coefficient de solubilité d'un soluté dans une quantité donnée de solvant est mentionné, il faut aussi indiquer la température, car il s'agit d'un facteur d'interférence. Par exemple, si l'on prend 100 g d'eau à 20°C et que l'on ajoute 40 g de sel, 36 g vont se solubiliser et 4 g vont former le précipité. Mais si on prend cette solution à chauffer, on verra que les 4 g vont se dissoudre au fur et à mesure que la température augmente.
Cela nous montre que le même soluté dissous dans la même quantité de solvant a des coefficients de solubilité différents lorsque la température augmente.
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
Voir un exemple ci-dessous :
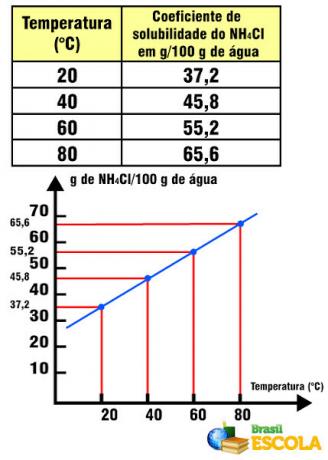
Coefficient de solubilité NH4Cl par rapport à la température
Notez que dans ce cas, le coefficient de solubilité de NH4Cl augmente avec l'augmentation de la température. Cela se produit avec la plupart des sels dans l'eau. Cependant, il existe des situations dans lesquelles le coefficient de solubilité diminue avec l'augmentation de la température, comme dans le cas de Ce2(SEUL4)3. Il existe également des cas dans lesquels il n'y a pas une variabilité aussi marquée du coefficient de solubilité, comme cela se produit avec le sel de table. Voir ceci dans le texte Graphiques des courbes de solubilité.
Il se peut que l'on puisse aussi, dans certaines situations particulières, dissoudre dans le solvant une quantité de soluté supérieure à son coefficient de solubilité, obtenant ainsi ce qu'on appelle solution sursaturée. Par exemple, imaginez qu'une solution formée avec 100 g d'eau, à 20°C, et 40 g de sel de table (avec 36 g dissous et 4 g précipité), est chauffé jusqu'à ce qu'il atteigne une température à laquelle tout le soluté solubilisez-vous. Ensuite, cette solution est laissée au repos pour qu'elle refroidisse jusqu'à ce qu'elle atteigne la température ambiante, qui est proche de 20ºC.
S'il n'y a pas de perturbation dans la solution, le soluté supplémentaire restera dissous, constituant ainsi une solution sursaturée. Cependant, ce type de solution est très instable et tout mouvement brusque peut provoquer la cristallisation de la quantité au-dessus du coefficient de solubilité pour cette température. Ainsi, la solution qui a été sursaturé va devenir saturé de corps d'arrière-plan.
Un dernier cas est le solution insaturée, c'est-à-dire lorsque la quantité de soluté dissous est inférieure à la valeur du coefficient de solubilité. Un exemple est la dissolution de 10 g de NaCl dans 100 g d'eau à 20°C.
Par Jennifer Fogaça
Diplômé en Chimie
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
FOGAÇA, Jennifer Rocha Vargas. « Coefficient de solubilité »; École du Brésil. Disponible en: https://brasilescola.uol.com.br/quimica/coeficiente-solubilidade.htm. Consulté le 28 juin 2021.