Dans les laboratoires et les industries chimiques, il est très important de connaître la quantité de substances impliquées dans les réactions. Par conséquent, ci-dessous, nous traiterons des principaux concepts, quantités et unités de mesure liés aux masses d'atomes :
- Unité de masse atomique (u) :
L'atome de référence de poids standard pour désigner l'unité de masse atomique est le carbone-12 (12Ç). Une unité de masse atomique (1 u) correspond à la valeur de 1,66054. 10-24 g, qui est la masse de 1/12 de l'isotope du carbone de masse égale à 12 (12Ç).
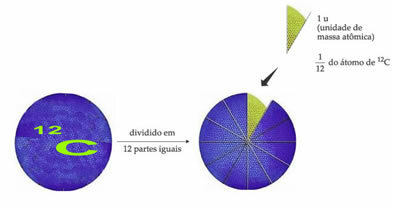
L'unité de masse atomique (u) est l'unité utilisée dans toutes les quantités énumérées ci-dessous.
- Masse atomique d'un atome ou d'un isotope (MA) :
Elle est obtenue en la comparant à la valeur de référence mentionnée au point précédent. Par exemple, la masse atomique de 919F est donné par le spectromètre de masse, qui est égal à 18,9984 u. En arrondissant, il est égal à 19, qui est la même valeur que son nombre de masse (A). Cette valeur signifie que la masse atomique de l'élément 919F est 19 fois plus grand que la masse de 1/12 du 12Ç.
- Masse atomique d'un élément (MA) :
La masse atomique de l'élément est déterminée par la moyenne pondérée des masses atomiques de ses isotopes. Cela se fait en multipliant les masses atomiques de chaque isotope par le pourcentage qui apparaît dans la constitution de l'élément. Ces valeurs sont ensuite additionnées, qui sont divisées par 100, ce qui donne le pourcentage total.
Par exemple, l'élément néon est composé de trois isotopes avec les masses atomiques et les pourcentages suivants dans leur constitution :

Calcul de la masse atomique (MA) de cet élément :
MALnéon = (20. 90,92) + (21. 0,26) + (22. 8,82)
100
MALnéon = 20 179 u
- Masse moléculaire (MM) :
Comme son nom l'indique, il est utilisé pour les substances moléculaires, c'est-à-dire les atomes liés par un partage de paires d'électrons, appelés liaisons covalentes.
La masse moléculaire est obtenue en multipliant le nombre d'atomes de chaque élément par leurs masses atomiques et en additionnant les résultats.
Par exemple, la molécule de CO2 contient un carbone et deux oxygènes, nous allons donc multiplier la masse atomique du carbone par 1; et l'oxygène par deux, en les ajoutant plus tard :
MMCO2 = (1. MALÇ) + (2. MALO)
MMCO2 = (1. 12) + (2. 16)
MMCO2 = 12 + 32
MMCO2 = 44 u
- Masse-Formule :
C'est le même calcul effectué pour la masse moléculaire, cependant, pour les composés ioniques. Dans ce cas le nom est différent car ils ne sont pas regroupés en molécules, mais en amas d'ions. Comme les molécules n'existent pas, il n'y a évidemment aucun sens à parler de masse moléculaire, mais le raisonnement derrière le calcul est le même.
Exemple:
NaCl
↓ ↓
23 +35,5 → Masse de la formule = 58,5 u
Par Jennifer Fogaça
Diplômé en Chimie
La source: École du Brésil - https://brasilescola.uol.com.br/quimica/massas-dos-atomos.htm

