Dans le réactions d'additiondans alcènes(hydrocarbures qui ont une double liaison entre deux atomes de carbone), une liaison pi entre deux carbones est rompue et chacun des carbones s'attache à un nouvel atome. Voir:
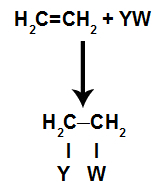
Modèle schématique général d'une réaction d'addition
Principes d'une réaction d'addition
a) Rupture du lien pi
Une liaison pi est facilement rompue car c'est une liaison plus faible qu'une liaison sigma. Cependant, pour que cela se produise, il faut que l'alcène soit soumis à des conditions qui assurent cette rupture. Après avoir rompu la liaison pi entre deux carbones, un site de liaison (pour les nouveaux atomes) apparaît toujours sur chacun des carbones impliqués.
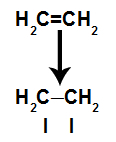
Schéma illustrant la rupture du lien pi
b) Conditions de rupture d'une liaison pi
Les facteurs qui favorisent la rupture d'une liaison pi sont :
Utilisation de catalyseurs ;
Chauffage;
Présence d'un acide dans le milieu réactionnel.
c) L'apparition de la réaction d'addition
Les sites de liaison créés après la rupture de la liaison pi seront toujours occupés par des atomes du réactif qui se trouvent dans le même conteneur que l'alcène. La réaction d'addition est nommée d'après le type de réactif mélangé à l'alcène.
Types de réactions d'addition dans les alcènes
a) Hydrogénation
Un alcène est mélangé avec de l'hydrogène gazeux (H2) dans un récipient et soumis à l'action d'un catalyseur solide (nickel, platine ou palladium) et à un chauffage (Δ).
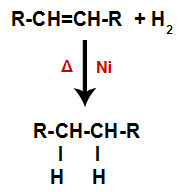
Schéma général d'une réaction d'hydrogénation dans les alcènes
La présence du catalyseur et le chauffage provoquent la liaison pi de l'alcène et la liaison sigma entre les hydrogènes de H2 être rompu plus rapidement. Avec cela, nous avons la création de deux sites de liaison dans l'alcène et de deux atomes d'hydrogène libres dans le milieu réactionnel.

Création de sites de liaison et de séparation des atomes
Ainsi, immédiatement après, chaque atome d'hydrogène libre occupe l'un des sites de liaison formés dans l'alcène. Comme la substance formée n'a que des carbones et des hydrogènes, ainsi que des liaisons simples entre les carbones, c'est un hydrocarbure.
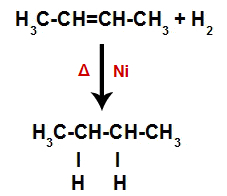
Équation représentant la formation d'alcane dans l'hydrogénation
B) Halogénation
Un alcène est mélangé à des substances simples (F2, Cl2, fr2 Hey2) formé par halogènes (chlore, fluor, iode et brome) dans un récipient et soumis à l'action de la lumière (λ) et du chauffage (Δ).

Schéma général d'une réaction d'halogénation dans les alcènes
L'action de la lumière et du chauffage font que la liaison pi de l'alcène et la liaison sigma entre les substances formées par l'halogène se rompent plus rapidement. Avec cela, nous avons la création de deux sites de liaison dans l'alcène et de deux atomes d'halogène libres dans le milieu réactionnel.

Création de sites de liaison et de séparation des atomes
Ainsi, immédiatement après, chaque atome d'halogène libre occupe l'un des sites de liaison formés dans l'alcène. Comme la substance formée a un halogène lié à une structure composée de carbones et d'hydrogènes, c'est un halogénure organique.

Équation représentant la formation d'halogénures organiques dans l'halogénation
c) Hydratation
Un alcène est mélangé avec de l'eau (H2O) dans un récipient et soumis à l'action d'un catalyseur (en l'occurrence de l'acide sulfurique).
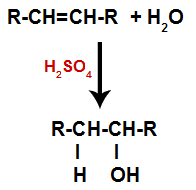
Schéma général d'une réaction d'hydratation dans les alcènes
La présence d'acide sulfurique dans la réaction fait que la liaison pi de l'alcène et la liaison sigma entre l'hydrogène (H) et l'hydroxyle (OH) de l'eau se rompent plus rapidement. Avec cela, nous avons la création de deux sites de liaison dans l'alcène et un hydrogène libre et un hydroxyle dans le milieu réactionnel.
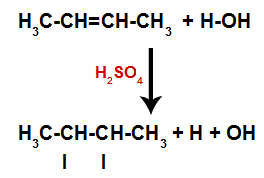
Création de sites de liaison et de séparation des atomes
Ainsi, peu de temps après, l'hydrogène et l'hydroxyle occupent l'un des sites de liaison formés dans l'alcène. Comme la substance formée a un hydroxyle lié à un carbone saturé (elle ne fait que des liaisons simples), c'est un alcool.
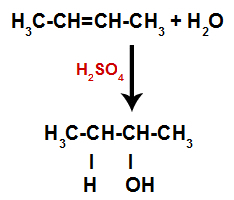
Équation représentant la formation d'alcool dans l'hydratation
d) Addition avec des halogénures d'hydrogène
Un alcène est mélangé à un acide inorganique halogéné (HF, HI, HCl, HBr) dans un récipient.

Schéma général d'une réaction d'halogénure d'acide dans les alcènes
La présence d'acide dans la réaction provoque la rupture plus rapide de la liaison pi de l'alcène. La liaison simple dans l'acide est rompue parce que ces substances s'ionisent naturellement. Ainsi, deux sites de liaison sont créés dans l'alcène et il y a présence d'un hydrogène libre et d'un halogène dans le milieu réactionnel.
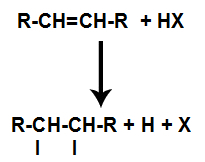
Création de sites de liaison et de séparation des atomes
Ainsi, peu de temps après, l'hydrogène et l'halogène occupent l'un des sites de liaison formés dans l'alcène. Comme la substance formée a un halogène lié à une structure composée de carbones et d'hydrogènes, il s'agit d'un halogénure organique.
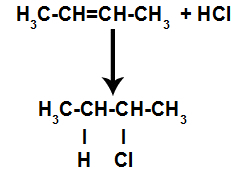
Équation représentant la formation d'halogénures organiques dans l'halogénation
Par moi Diogo Lopes Dias
La source: École du Brésil - https://brasilescola.uol.com.br/quimica/reacoes-adicao-alcenos.htm

