LA classification périodique des éléments a été proposé en 1913 par Henry Monseley (1887-1915), qui a identifié la variation périodique de nombreux propriétés à intervalles réguliers en fonction du nombre de protons dans le noyau de l'atome d'un élément chimique.
En raison de l Loi de périodicité, le critère utilisé pour organiser les éléments du tableau périodique actuel est l'ordre croissant du numéro atomique (Z).
Les 118 éléments chimiques sont classés en groupes et en périodes du tableau périodique. Selon les propriétés physiques et chimiques, il est possible de distinguer entre métaux, non-métaux (non-métaux) et semi-métaux (métalloïdes).

Les lignes verticales sont les 18 groupes le tableau et regrouper des éléments aux propriétés chimiques similaires. Les lignes horizontales correspondent aux 7 périodes et présente les éléments avec le même nombre de couches électroniques.
L'hydrogène est un élément qui se positionne au-dessus du groupe 1 en raison de sa distribution électronique, mais il n'a pas de caractéristiques communes avec eux.
Vérifiez Tableau périodique complet et mis à jour.
métaux
La plupart des éléments chimiques du tableau périodique sont classés comme métaux. Les principales caractéristiques des métaux sont :
- Ils ont un éclat caractéristique;
- Ils sont denses, malléables et ductiles ;
- Ce sont de bons conducteurs d'électricité et de chaleur;
- Ils sont présents dans les conditions ambiantes à l'état solide, à l'exception du mercure.
Les éléments métalliques du tableau périodique sont :
métaux alcalins (groupe 1): lithium, sodium, potassium, rubidium, césium et francium.
métaux alcalino-terreux (groupe 2): béryllium, magnésium, calcium, strontium, baryum et radium.
Affaires représentatives, en plus des éléments des groupes 1 et 2, sont: l'aluminium, le gallium, l'indium, le thallium, le nion, l'étain, le plomb, le flerovium, le bismuth, le muscovium et le livermorium.
Métaux de transition externes sont les éléments qui occupent la partie centrale du tableau périodique :
- Groupe 3: scandium et yttrium.
- Groupe 4: titane, zirconium, hafnium et rutherfordium.
- Groupe 5: vanadium, niobium, tantale et dubnium.
- Groupe 6: chrome, molybdène, tungstène et seaborgium.
- Groupe 7: manganèse, technétium, rhénium et bohrium.
- Groupe 8: fer, ruthénium, osmium et hassium.
- Groupe 9: cobalt, rhodium, iridium et meitnerium.
- Groupe 10: nickel, palladium, platine, darmstadium.
- Groupe 11: cuivre, argent, or et roentgen.
- Groupe 12: zinc, cadmium, mercure et copernicium.
Métaux de transition internes sont les éléments qui font partie du groupe 3 et correspondent aux éléments de la série des lanthanides et des actinides.
La série des lanthanides comprend le lanthane, le cérium, le praséodyme, le néodyme, le prométhium, le samarium, l'europium, le gadolinium, le terbium, le dysprosium, l'holmium, l'erbium, le thulium, l'ytterbium et le lutétium.
La série des actinides contient les éléments actinium, thorium, protactinium, uranium, neptunium, plutonium, américium, curium, berkelium, californium, einsteinium, fermium, mendelevium, nobelium et laurence.
En savoir plus sur le métaux alcalins.
non-métaux
Les non-métaux sont situés dans la partie droite du tableau périodique et ont des caractéristiques opposées aux métaux, par exemple :
- Ils n'ont pas un aspect brillant ;
- Ce ne sont pas de bons conducteurs d'électricité et de chaleur, ils sont donc utilisés comme isolants;
- Ils ont des points d'ébullition et de fusion bas, c'est pourquoi beaucoup se trouvent dans la nature à l'état liquide.
Toi éléments non métalliques du tableau périodique sont: l'hydrogène, l'azote, l'oxygène, le carbone, le phosphore, le sélénium, le soufre, les halogènes et les gaz nobles.
Toi halogènes sont les éléments qui appartiennent au groupe 17: le fluor, le chlore, le brome, l'iode, l'astatine, la ténessine et la famille des gaz nobles.
Toi gaz nobles sont les éléments qui appartiennent au groupe 18: hélium, néon, argon, krypton, xénon, radon, oganesson.
En savoir plus sur le gaz nobles et le halogènes.
semi-métaux
Les semi-métaux ou métalloïdes sont: le bore, le silicium, le germanium, l'arsenic, l'antimoine, le tellure et le polonium. Ces éléments ont des caractéristiques intermédiaires entre les métaux et les non-métaux.
A lire également sur le familles de tableaux périodiques.
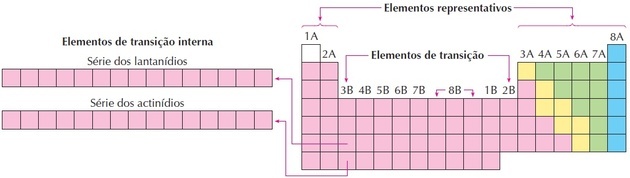
Éléments représentatifs et de transition
Une autre façon de classer les éléments consiste à les diviser en éléments représentatifs et éléments de transition selon la distribution électronique de l'atome.

Toi éléments représentatifs sont ceux dont la configuration électronique se termine par le sous-niveau le plus énergétique dans s (groupes 1 et 2) ou pour (groupes 13, 14, 15, 16, 17 et 18).

Toi éléments de transition sont séparés en transition externe, avec les éléments qui ont l'électron le plus énergétique dans le sous-niveau ré et ceux de transition interne, où l'électron le plus énergétique est dans un sous-niveau F.

Acquérir plus de connaissances avec le contenu :
- propriétés périodiques
- Exercices de tableau périodique
- Exercices sur l'organisation du tableau périodique