L'une des façons dont les éléments chimiques sont organisés est à travers des familles, qui correspondent aux séquences verticales du tableau périodique.
À 18 colonnes du tableau regroupent les éléments selon des similitudes de propriétés chimiques.
Organiser les éléments chimiques en familles était un moyen pratique de structurer les différentes informations trouvées et de les présenter de manière simple.
Pour faciliter la localisation d'un élément chimique, les familles ont été désignées par des numéros de 1 à 18 comme suit :
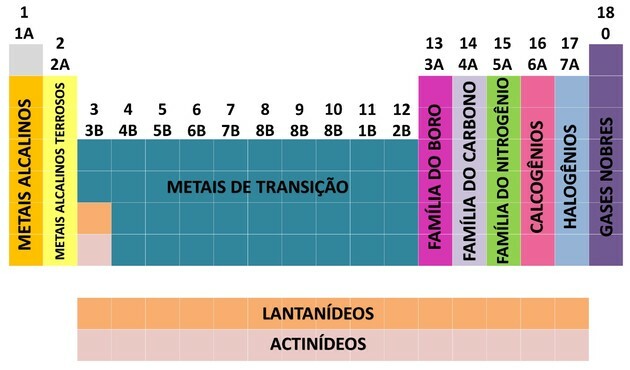
Grâce à la contribution de nombreux scientifiques et à diverses tentatives pour organiser les données, le tableau périodique a évolué, établissant un ordre pour organiser les éléments.
Nomenclature des familles
- Les familles du tableau ont été divisées en A (représentant) et B (transition), identifiées par des lettres et des chiffres.
- Toi éléments représentatifs les familles 0, 1A, 2A, 3A, 4A, 5A, 6A et 7A correspondent.
- Toi éléments de transition les familles 1B, 2B, 3B, 4B, 5B, 6B, 7B et 8B correspondent.
- Par détermination de l'Union internationale de chimie pure et appliquée (IUPAC), les familles ont été identifiées dans groupes de 1 à 18.
Tableau périodique et distribution électronique
Les similitudes entre les éléments d'une même famille se produisent parce que le nombre d'électrons de valence de l'atome dans l'état fondamental est le même pour les membres d'un certain groupe.
Par example:
| Groupe 1 | Diffusion électronique |
|---|---|
| 3lis | 2-1 |
| 11À | 2-8-1 |
| 19K | 2-8-8-1 |
| 37Rb | 2-8-18-8-1 |
| 55Cs | 2-8-18-18-8-1 |
| 87Fr | 2-8-18-32-18-8-1 |
Les atomes du groupe 1 ont leurs électrons répartis sur plus d'un niveau d'énergie, mais tous ont un électron de valence.
Avec cela, nous observons que faire le diffusion électronique de l'atome à l'état fondamental, on retrouve sa position sur le tableau périodique.
éléments représentatifs
Les éléments représentatifs présentent un comportement chimique relativement moins complexe que les éléments de transition et forment la plupart des substances qui nous entourent.
Certaines des familles d'éléments représentatives reçoivent des noms spéciaux, comme indiqué ci-dessous :
Grouper |
Famille | nom spécifique | Origine du nom | Éléments | configuration électronique |
|---|---|---|---|---|---|
| 1 | 1A | métaux alcalins | du latin alcali, qui signifie « gris des plantes ». | Li, Na, K, Rb, Cs et Fr | nous1 |
| 2 | 2A | métaux alcalino-terreux | Le terme « terrestre » fait référence à « existant sur terre ». | Be, Mg, Ca, Sr, Ba et Ra | nous2 |
| 13 | 3A | famille du bore | Nom du premier élément de la famille. | B, Al, Ga, In, Tl et Nh. | nous2np1 |
| 14 | 4A | famille de carbone | Nom du premier élément de la famille. | C, Si, Ge, Sn, Pb et Fl. | nous2np2 |
| 15 | 5A | Famille de l'azote | Nom du premier élément de la famille. | N, P, As, Sb, Bi et Mc. | nous2np3 |
| 16 | 6A | Chalcogènes | du grec kalks, car ce sont des éléments trouvés dans les minerais de cuivre. | O, S, Se, Te, Po et Lv. | nous2np4 |
| 17 | 7A | Halogènes | Expression grecque signifiant salifères. | F, Cl, Br, I, At et Ts. | nous2np5 |
| 18 | 0 | Gaz nobles | Il a été considéré qu'il ne réagissait pas avec d'autres substances. | He, Ne, Ar, Kr, Xe, Re et Og. | 1s2 (Il) ou nous2np6 |
A travers le tableau, on peut voir que :
- Les éléments présentés ci-dessus sont classés comme représentatifs car ils ont l'électron le plus énergétique dans un sous-niveau s ou p.
- Les électrons sont répartis sur les niveaux d'énergie et n représente le niveau le plus externe de l'atome dans l'état fondamental.
- Les éléments représentatifs, selon la recommandation de l'IUPAC, appartiennent aux groupes ou familles 1,2,13,14,15,16,17 et 18.
O hydrogène il est classé à part des autres éléments. Même avec une configuration électronique 1s1, il ne fait pas partie du groupe 1 pour avoir présenté un comportement singulier.
éléments de transition
Les éléments de transition correspondent aux groupes 3 à 12. Ils reçoivent ce nom car ils ont des caractéristiques intermédiaires entre les groupes 1 et 2 et les éléments non métalliques représentatifs.
Toi métaux de transition sont définis par l'IUPAC comme :
Un élément de transition a un sous-niveau d incomplet ou peut former des cations avec un sous-niveau d incomplet.
Lorsque l'électron le plus énergétique de l'atome de l'état fondamental se trouve dans un sous-niveau d incomplet, il est caractérisé comme une transition externe.
Les lanthanides et les actinides sont des éléments de transition internes car ils ont au moins un sous-niveau f incomplet.
Lorsque les éléments ont des électrons qui remplissent les orbitales d ou f, ils présentent des propriétés similaires et peuvent être classés en éléments orbitaux d ou f. transition extérieure ou intérieure.
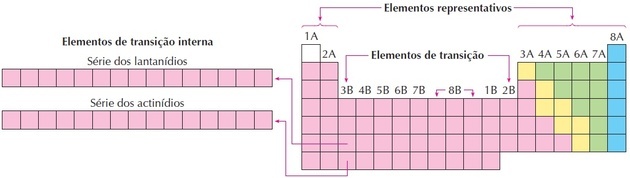
Comme on peut le voir sur l'image, la famille 8B correspond à 3 colonnes, ce sont les groupes 8, 9 et 10, qui ont été regroupés ainsi car ils ont des caractéristiques similaires.
Principales caractéristiques des familles
Le tableau ci-dessous montre les principales propriétés des groupes du tableau périodique :
| Grouper | Caractéristiques | substances composées plus commun |
occurrences |
|---|---|---|---|
| 1 | Solide et brillant dans des conditions ambiantes. Très réactif, doux et bons conducteurs d'électricité. | Sels, hydroxydes et oxydes |
Réagit avec les halogènes et forme des sels. |
| 2 | Moins réactif et plus dur que le groupe 1. Solides d'argent avec une bonne conductivité. | Sels, hydroxydes et oxydes |
Formation de sels et d'oxydes. |
| 3 à 12 | Ils forment des complexes. Ce sont des solides métalliques, durs et cassants, à l'exception du mercure qui est un liquide. | Sels, oxydes et complexes. Exemple: AgNO3, TiO et [Cr(OH)3(H2O)3] |
En minéraux sous forme d'oxydes. |
| 13 | Solides dans les conditions ambiantes, argent, à l'exception du bore. | Oxydes Exemple: B2O3 |
En minéraux sous forme d'oxydes. |
| 14 | Solide dans les conditions ambiantes. | Les atomes de C et de Si peuvent s'organiser en chaînes et produire une grande variété de substances. | Dans les organismes vivants et sous forme de silicates ou d'oxydes. |
| 15 | Solides, à l'exception de l'azote, qui est gazeux dans les conditions ambiantes. | Oxydes et acides Exemple: NON2 et H3POUSSIÈRE4 |
Atmosphère, organismes vivants et minéraux. |
| 16 | Solides, à l'exception de l'oxygène, qui est gazeux dans les conditions ambiantes. | Sulfures et oxydes Ex: ZnS et SiO2 |
Atmosphère, organismes vivants et minéraux. |
| 17 | Ils forment des molécules diatomiques et sont très réactifs. Ce sont de mauvais conducteurs d'électricité et de chaleur. Ils sont agressifs envers les êtres vivants et l'environnement. | Acides et sels. Ex: HCl et KBr |
Sont présents dans les substances organique et minéral. |
| 18 | Ils sont très stables et se trouvent sous forme de gaz. | Ils forment à peine des substances composées. | Gaz dans l'atmosphère. |
Les propriétés chimiques et physiques distinguent une famille d'une autre. Comme nous l'avons vu, les propriétés chimiques sont liées à électrons de valence, et à travers eux, un atome interagit avec un autre, étant responsable du comportement chimique et liaisons chimiques formé.
Les propriétés physiques des éléments d'un même groupe peuvent varier en fonction du numéro atomique et de la masse.
Des exercices
Maintenant que vous en savez un peu plus sur les familles de tableaux périodiques, testez vos connaissances et voyez ce que vous avez appris.
1) Considérez l'extrait suivant du tableau périodique.
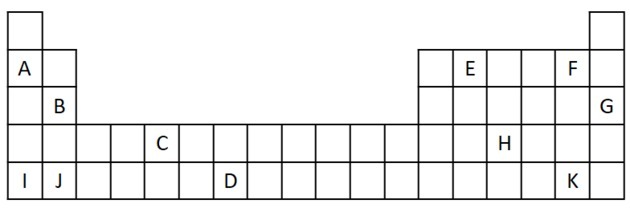
a) Nommez deux éléments qui ont deux électrons de valence.
b) Indiquer un élément qui réagit violemment avec l'eau, produisant un hydroxyde métallique.
c) Indiquez un élément non réactif.
d) Indiquez deux éléments qui se combinent avec des métaux alcalins pour former des sels.
Réponse:
a) B et J
Deux électrons de valence correspondent au groupe 2, qui a une configuration électronique ns2 et sont représentés dans l'exercice par B et J.
b) A, B, I ou J.
A et I représentent des éléments de la famille 1; B et J sont de la famille 2. Comme nous l'avons vu dans le tableau des propriétés, les éléments des groupes 1 et 2 sont très réactifs et peuvent former des hydroxydes, comme dans les exemples donnés: KOH et Mg (OH)2.
c) G
Les gaz nobles sont très stables et donc peu réactifs. La lettre G est insérée dans le tableau comme élément de cette famille.
d) F et K
Les halogènes réagissent avec les métaux alcalins pour former des sels. L'exemple le plus courant est le sel de table, NaCl.
2) La figure suivante montre trois éléments chimiques, de gauche à droite, le lithium, le sodium et le potassium.

Sélectionnez l'option qui complète correctement chacune des instructions suivantes.
1.1) « On peut dire que le lithium, le sodium et le potassium…
(A) … appartiennent à la même période.
(B) … a le même numéro atomique.
(C) … appartiennent au même groupe.
(D) … a le même nombre de masse.
1.2) "Les éléments lithium, sodium et potassium...
(A) … a des propriétés chimiques très similaires.
(B) … a des propriétés chimiques très différentes.
(C) … sont des non-métaux.
(D) … réagissent avec l'eau pour former des solutions acides.
Réponses:
1.1) (C) appartiennent au même groupe.
1.2) (A) a des propriétés chimiques très similaires.
On peut obtenir ces informations en consultant le tableau périodique ou en faisant la répartition électronique des éléments lithium, sodium et potassium. Nous verrons que les trois ont un électron dans la couche de valence et parce qu'ils font partie du même groupe, les propriétés chimiques sont très similaires.
3) Considérez le tableau suivant, où les numéros atomiques et les distributions électroniques de certains éléments chimiques sont représentés.
| Élément | symbole chimique | numéro atomique | Diffusion électronique |
|---|---|---|---|
| Lithium | lis | 3 | 2,1 |
| Béryllium | être | 4 | 2,2 |
| Fluor | F | 9 | 2,7 |
| néon | Hein | 10 | 2,8 |
| chlore | Cl | 17 | 2,8,7 |
| argon | Air | 18 | 2,8,8 |
| Potassium | K | 19 | 2,8,8,1 |
| Calcium | Ici | 20 | 2,8,8,2 |
Indiquez le groupe de chaque élément.
Réponse:
Lithium et potassium: groupe 1. (Ils ont un électron dans la couche de valence).
Béryllium et calcium: groupe 2. (Ils ont deux électrons dans la couche de valence).
Fluor et chlore: groupe 17. (Ils ont sept électrons dans la couche de valence).
Néon et argon: groupe 18. (Ils ont huit électrons dans la couche de valence).
Vérifiez les questions d'examen d'entrée avec une résolution commentée dans Exercices sur le tableau périodique et des questions inédites sur le sujet dans Exercices sur l'organisation du tableau périodique.