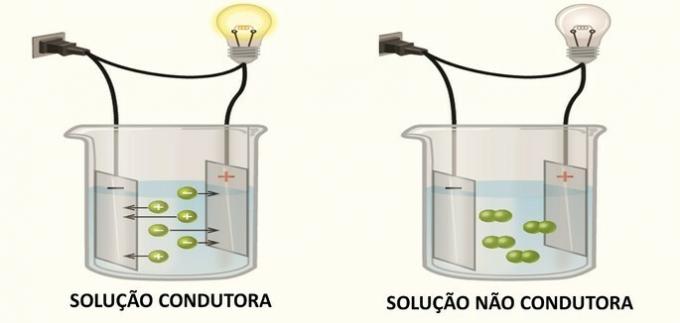
La concentration courante est la quantité de soluté, en grammes, dans 1 litre de solution.
Mathématiquement, la concentration commune s'exprime par:
1. (Mackenzie) Quelle est la concentration, en g/L, de la solution obtenue en dissolvant 4 g de chlorure de sodium dans 50 cm3 de l'eau?
a) 200 g/l
b) 20g/L
c) 0,08 g/l
d) 12,5 g/l
e) 80g/L
Alternative correcte: e) 80 g/L.
1ère étape: Transformer l'unité de volume en cm3 à L.
Sachant que 1 cm3 = 1 mL, alors on a :
Étape 2: Appliquez les données de la formule de concentration commune :
2. (Mackenzie) Il y a cinq récipients contenant des solutions aqueuses de chlorure de sodium.
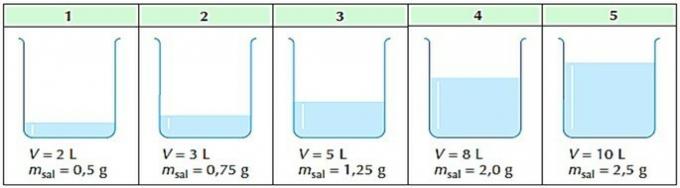
Il est juste de dire que :
a) le conteneur 5 contient la solution la moins concentrée.
b) le conteneur 1 contient la solution la plus concentrée.
c) seuls les conteneurs 3 et 4 contiennent des solutions de concentration égale.
d) les cinq solutions ont la même concentration.
e) le conteneur 5 contient la solution la plus concentrée.
Alternative correcte: d) les cinq solutions ont la même concentration.
Application de la formule de concentration commune pour chacun des conteneurs, nous avons :
| 1 | 2 | 3 | 4 | 5 |
|---|---|---|---|---|
D'après les calculs effectués, nous voyons que toutes les solutions ont la même concentration.
3. (UFPI) La nouvelle législation routière prévoit une limite maximale de 6 décigrammes d'alcool, C2H5OH, par litre de sang du conducteur (0,6 g/L). Considérant que le pourcentage moyen d'alcool ingéré qui reste dans le sang est de 15 % en masse, identifiez, pour un adulte d'un poids moyen de 70 kg dont le volume sanguin est de 5 litres, le nombre maximum de canettes de bière (volume = 350 mL) ingérées sans que la limite établie soit dépassé. Informations complémentaires: la bière a 5% d'alcool en volume, et la densité d'alcool est de 0,80 g/mL.
à 1
b) 2
c) 3
d) 4
e) 5
Alternative correcte: a) 1.
Données des questions :
- Limite d'alcoolémie maximale autorisée: 0,6 g/L
- Pourcentage d'alcool ingéré restant dans le sang: 15 %
- Volume sanguin: 5 L
- Volume de la canette de bière: 350 ml
- Pourcentage d'alcool dans la bière: 5%
- Densité alcoolique: 0,80 g/mL
1ère étape: Calculer la masse d'alcool dans 5 L de sang.
2ème étape: Calculez la masse totale d'alcool, car seulement 15 % ont été absorbés dans la circulation sanguine.
3ème étape: Calculer le volume d'alcool présent dans la bière.
4ème étape: Calculez le volume maximum de bière pouvant être consommé.
5ème étape: Interprétation des résultats.
Le volume maximum de bière qu'une personne peut boire pour que la concentration d'alcool dans le sang ne dépasse pas 0,6 g/L est de 500 ml.
Chaque bière contient 350 ml et lors de la consommation de deux canettes, le volume est de 700 ml, ce qui dépasse le volume établi. En tant que tel, le maximum qu'une personne peut ingérer est une canette.
4. (UNEB) Le sérum maison se compose d'une solution aqueuse de chlorure de sodium (3,5 g/L) et de saccharose (11 g/L). Les masses de chlorure de sodium et de saccharose nécessaires pour préparer 500 ml de sérum maison sont respectivement :
a) 17,5 g et 55 g
b) 175 g et 550 g
c) 1750mg et 5500mg
d) 17,5 mg et 55 mg
e) 175 mg et 550 mg
Alternative correcte: c) 1750mg et 5500mg.
Calculer la masse de chlorure de sodium
1ère étape: Transformez l'unité de volume de mL en L.
2ème étape: Calculer la masse en grammes.
3ème étape: Transformez la valeur trouvée en milligrammes.
Calculer la masse de saccharose
1ère étape: Calculer la masse en grammes.
Sachant que 500 mL = 0,5 L, alors on a :
2ème étape: Transformez la valeur trouvée en milligrammes.
a) 8,0
b) 6,0
c) 4,0
d) 2,0
e) 1,0
Alternative correcte: d) 2.0.
1ère étape: Transformez l'unité de volume de mL en L.
2ème étape: Calculer la masse de chlorure de magnésium (MgCl2).
a) 6.0. 101 kg
b) 6.0. 104 kg
c) 1.8. 102 kg
d) 2.4. 108 kg
e) 8.0. 106 kg
Alternative correcte: a) 6.0. 101 kg.
1ère étape: Calculer la masse de sels dissous dans l'aquarium.
Sachant que 1 L = 1000 mL = 1000 cm3, on a:
Étape 2: Transformez l'unité de masse de grammes en kilos.
3ème étape: Transformer le résultat en notation scientifique.
En tant que nombre en notation scientifique, il a le format N. 10non, pour transformer 60 kg en notation scientifique on « marche » avec la virgule et on la place entre 6 et 0.
Nous avons N = 6,0 et comme nous ne parcourons qu'une décimale, la valeur de n est 1 et la bonne réponse est: 6,0. 101 kg.
Bonne réponse: 40 gouttes.
Données des questions :
- Dose analgésique recommandée: 3 mg/kg
- Quantité d'antalgique en goutte: 5 mg d'antalgique
- poids du patient: 70 kg
1ère étape: Calculer la quantité d'analgésique en fonction du poids du patient.
La quantité calculée dépasse la dose maximale. Par conséquent, 200 mg doivent être administrés, ce qui correspond à la limite autorisée.
2ème étape: Calculer la quantité de goutte analgésique.
8. (Enem) Une station donnée traite environ 30 000 litres d'eau par seconde. Pour éviter le risque de fluorose, la concentration maximale de fluorures dans cette eau ne doit pas dépasser environ 1,5 milligramme par litre d'eau. La quantité maximale de cette espèce chimique qui peut être utilisée en toute sécurité, dans le volume d'eau traité en une heure, à cette station, est :
a) 1,5 kg
b) 4,5 kg
c) 96 kg
d) 124 kg
e) 162 kg
Alternative correcte: e) 162 kg.
Données des questions :
- Eau traitée: 30 000 L/s
- Concentration de fluorure: 1,5 mg/L
1ère étape: Transformez l'heure en minutes.
2ème étape: Calculer la masse de fluorure en 30000 L/s.
3ème étape: Calculer la masse pour le temps de 1 h (3600 s).
Étape 4: Transformez l'unité de masse de mg en kg.
9. (UFRN) L'un des potentiels économiques du Rio Grande do Norte est la production de sel marin. Le chlorure de sodium est obtenu à partir de l'eau de mer dans des marais salants construits près de la côte. En général, l'eau de mer traverse plusieurs bacs de cristallisation jusqu'à une concentration déterminée. Supposons qu'à l'une des étapes du processus, un technicien prélève 3 échantillons de 500 mL dans un réservoir de cristallisation, effectué l'évaporation avec chaque échantillon et noté la masse de sel résultante dans le tableau a poursuivre:
| Goûter | Volume d'échantillon (mL) | Masse de sel (g) |
|---|---|---|
| 1 | 500 | 22 |
| 2 | 500 | 20 |
| 3 | 500 | 24 |
La concentration moyenne des échantillons sera :
a) 48g/L
b) 44 g/l
c) 42 g/l
d) 40g/L
Alternative correcte: b) 44 g/L.
1ère étape: Transformez l'unité de volume de mL en L.
Étape 2: Appliquer la formule de concentration commune pour chacun des échantillons.
| 1 | 2 | 3 |
|---|---|---|
3ème étape: Calculer la concentration moyenne.
10. (Fuvest) Considérons deux canettes du même soda, l'une dans la version « régime » et l'autre dans la version commune. Les deux contiennent le même volume de liquide (300 ml) et ont la même masse à vide. La composition du réfrigérant est la même dans les deux cas, à une différence près: la version commune contient un certain quantité de sucre, alors que la version « régime » ne contient pas de sucre (seulement une masse négligeable d'un édulcorant artificiel). En pesant deux canettes de soda fermées, les résultats suivants ont été obtenus :
| Goûter | Masse (g) |
|---|---|
| Peut avec du soda ordinaire | 331,2 g |
| Canette avec soda "régime" | 316,2 g |
Sur la base de ces données, on peut conclure que la concentration, en g/L, de sucre dans les boissons gazeuses ordinaires est d'environ :
a) 0,020
b) 0,050
c) 1.1
d) 20
e) 50
Alternative correcte: e) 50.
1ère étape: Calculer la masse de sucre.
Comme la seule différence entre les boissons gazeuses est la masse de sucre, car elle n'est présente que dans la version courante, nous pouvons la trouver en soustrayant les masses données à chaque échantillon.
2ème étape: Transformez l'unité de volume de mL en L.
3ème étape: Calculer la concentration en sucre.
Pour en savoir plus sur les solutions chimiques, consultez également ces textes.:
- Soluté et solvant
- Dilution des solutions
- Molarité
- Molalité