Les principales fonctions inorganiques sont: acides, bases, sels et oxydes.
Les composés inorganiques ont des propriétés différentes et sont présents dans de nombreuses situations de notre vie quotidienne. Pour cette raison, ce sujet est beaucoup discuté dans les examens d'entrée, en Enem et dans les compétitions.
Pour vous aider à vous préparer aux examens, nous avons créé cette liste de 15 questions avec des résolutions commentées et des approches différentes pour chaque fonction inorganique.
Concepts généraux
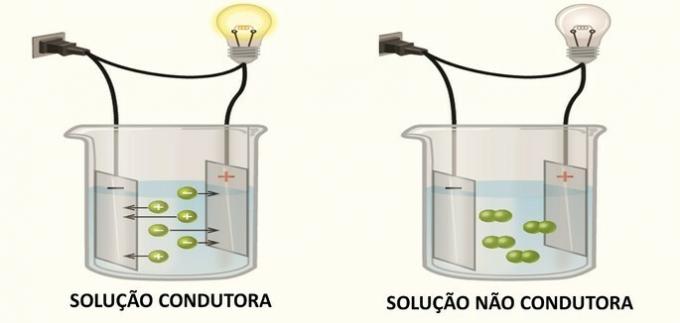
1. (FGV) Certains composés, lorsqu'ils sont solubilisés dans l'eau, génèrent une solution aqueuse qui conduit l'électricité. Parmi les composés ci-dessous :
| JE. À2SEUL4 |
| II. O2 |
| III. Ç12H22O11 |
| IV. SAVOIR3 |
| V. CH3COOH |
| VU. NaCl |
Ils forment une solution aqueuse conductrice de l'électricité :
a) uniquement I, IV et VI
b) uniquement I, IV, V et VI
appel
d) seulement I et VI
e) seulement vu
Alternative correcte: b) uniquement I, IV, V et VI.
La conduction de l'électricité en solution se produit en raison de la formation d'espèces chargées électriquement, les ions, comme Arrhenius l'a découvert dans ses expériences.

Lorsque des ions se forment en solution, les cations (charge positive) migrent vers le pôle négatif et les anions (charge négative) migrent vers le pôle positif, fermant le circuit électrique et permettant le passage de chaîne.
Les composés qui en solution génèrent des espèces neutres ne conduisent pas l'électricité.
D'après ces informations, nous devons :
JE. CONDUIRE
En solution, le sel se dissocie et des ions se forment.
II. NE CONDUITE PAS
L'oxygène diatomique à température ambiante est une molécule inerte.
III. NE CONDUITE PAS
La formule présentée concerne le saccharose, un composé moléculaire qui, lorsqu'il entre en contact avec l'eau, ses molécules se dispersent, mais ne perdent pas leur identité.
IV. CONDUIRE
En solution, le sel se dissocie et des ions se forment.
V. CONDUIRE
L'acide acétique est un acide faible qui a une petite partie ionisée en solution.
VU. CONDUIRE
En solution, le sel se dissocie et des ions se forment.
2. (Mackenzie-SP)
L'équation ci-dessus représente une réaction
a) de dissociation ionique.
b) qui a un diacide comme réactif.
c) d'ionisation totale, formant le cation hydroxonium.
d) d'ionisation, produisant l'anion phosphure.
e) qui, lors d'une ionisation complète, produit un anion monovalent.
Alternative correcte: c) d'ionisation totale, formant le cation hydroxonium.
L'acide phosphorique est un composé chimique qui s'ionise au contact de l'eau et libère des ions H+.
L'ionisation se déroule en trois étapes :
| Premier pas | |
| Deuxième étape | |
| troisième étape | |
| somme de pas |
Les cations (H+) libéré réagissent avec l'eau, formant l'ion hydroxon (H3O+).
Selon ce raisonnement, nous devons :
Un tort. La dissociation se produit dans les composés ioniques et l'acide phosphorique est un composé moléculaire.
b) FAUX. L'acide phosphorique est un triacide car il possède trois hydrogènes ionisables.
c) CORRECT. Le cation hydroxonium, également appelé hydronium, est une espèce formée par la jonction d'un hydrogène ionisable avec de l'eau.
d) FAUX. L'anion produit est le phosphate (). La formule du phosphure est:
e) FAUX. L'anion formé () est trivalent car il a une charge 3.
3. Associez correctement les composés ci-dessous à leurs fonctions inorganiques respectives.
| JE. HBr, H3POUSSIÈRE4 et H2CO3 | ( ) acides |
| II. CO2, SEUL2 et Al2O3 | ( ) bases |
| III. Al2(OH)3, KOH et NH4Oh | ( ) sels |
| IV. NaCℓ, KNO3 et BaSO4 | ( ) oxydes |
Les acides sont des composés qui ont des hydrogènes ionisables.
(je) acides: HBr, H3POUSSIÈRE4 et H2CO3
Les bases ont l'ion hydroxyle.
(III) bases: Al2(OH)3, KOH et NH4Oh
Les sels sont des composés ioniques formés par des cations et des anions.
(IV) sels: NaCℓ, KNO3 et BaSO4
Les oxydes sont des composés formés par la jonction de l'oxygène avec d'autres éléments, à l'exception du fluor.
(II) oxydes: CO2, SEUL2 et Al2O3
Acides
4. Écrivez le nom des acides suivants :
a) HCl et HBr
Acide chlorhydrique et acide bromhydrique.
Les composés ci-dessus représentent des hydrates. Les acides de cette classe ont la formule HXA, où x représente le nombre d'hydrogènes (H) et A correspond à l'amétal lié.
La nomenclature de ces substances se fait comme suit :
| H | Cl | |
| Acide | Chlore | hydrique |
| Acide hydrochlorique |
| H | fr | |
| Acide | Brom | hydrique |
| acide bromhydrique |
b) HNO3 et HNO2
Acide nitrique et acide nitreux.
Les composés ci-dessus représentent des oxyacides avec deux nombres d'oxydation. Les acides de cette classe ont la formule HXAO, étant formé d'hydrogène, de non-métal et d'oxygène.
La nomenclature de ces substances se fait comme suit :
| H | N | O3 |
| Acide | Nitr | je suis |
| Acide nitrique. Le Nox de l'azote dans ce composé est de +5. |
Le composé Nox le plus bas est l'acide nitreux: HNO2.
| H | N | O2 |
| Acide | Nitr | OS |
| Acide nitreux. Le Nox de l'azote dans ce composé est de +3. |
c) HClO, HClO2, HClO3 et HClO4
Acides hypochloreux, chloreux, chlorique et perchlorique.
Les composés ci-dessus représentent des oxyacides avec quatre nombres d'oxydation. Les acides de cette classe ont la formule HXAO, étant formé d'hydrogène, d'oxygène et d'un non-métal de la famille 7A.
La nomenclature de ces substances se fait comme suit :
| Nox +1 | Acide | hippopotame | préfixe d'élément | OS |
| Nox +3 | Acide | - | préfixe d'élément | OS |
| Nox +5 | Acide | - | préfixe d'élément | je suis |
| Nox +7 | Acide | par | préfixe d'élément | je suis |
Les composés donnés dans l'alternative sont nommés comme suit :
| H | Cl | O | |
| Acide | hippopotame | chlore | OS |
| Acide hypochloreux. Le Nox du chlore dans ce composé est de +1. |
| H | Cl | O2 |
| Acide | chlore | OS |
| Acide chloré. Le Nox du chlore dans ce composé est de +3. |
| H | Cl | O3 |
| Acide | chlore | je suis |
| Acide chlorique. Le Nox du chlore dans ce composé est de +5. |
| H | Cl | O4 | |
| Acide | par | chlore | je suis |
| Acide perchlorique. Le Nox du chlore dans ce composé est de +7. |
5. (UVA-CE) acides HClO4, H2MnO4, H3POUSSIÈRE3, H4samedi2O7, en ce qui concerne le nombre d'hydrogènes ionisables, peut être classé en :
a) monoacide, diacide, triacide, tétraacide.
b) monoacide, diacide, triacide, triacide.
c) monoacide, diacide, diacide, tétraacide.
d) monoacide, monoacide, diacide, triacide.
Alternative correcte: c) monoacide, diacide, diacide, tétraacide.
L'ionisation des acides présentés se produit comme suit :
Les formules structurales nous montrent que les hydrogènes ionisables sont liés à l'oxygène.

Par la quantité d'hydrogènes ionisables, les acides peuvent être classés en:
| HClO4 | un hydrogène ionisable | monoacide |
| H2MnO4 | Deux hydrogènes ionisables | diacide |
| H3POUSSIÈRE3 | Deux hydrogènes ionisables | diacide |
| H4samedi2O7 | Quatre hydrogènes ionisables | tétracide |
Pour les oxyacides, les hydrogènes ionisables sont ceux qui sont directement liés à l'oxygène. L'acide phosphoreux a l'un de ses trois hydrogènes attaché à l'élément central, le phosphore, et est donc un diacide.
6. (UESPI) Soit la liste des acides ci-dessous, avec leurs degrés d'ionisation respectifs en pourcentage (α%) :
|
HClO4 (α% = 97%) |
H2SEUL4 (α% = 61%) |
H3BO3 (α% = 0,025%) |
H3POUSSIÈRE4 (α% = 27%) |
HNO3 (α% = 92%) |
Vérifiez la bonne déclaration :
a) H3POUSSIÈRE4 est plus fort que H2SEUL4.
b) HNO3 c'est un acide doux.
c) HClO4 est plus faible que HNO3.
d) H3POUSSIÈRE4 c'est un acide fort.
e) H3BO3 c'est un acide faible.
Alternative correcte: e) H3BO3 c'est un acide faible.
La valeur de correspond au degré d'ionisation et se calcule par :
Plus la valeur de , plus l'acide est fort car cela signifie que plus d'espèces ionisées ont été libérées dans la solution.
Selon ce raisonnement, nous devons :
Un tort. Plus la valeur de , plus l'acide est fort. le H2SEUL4 a un degré d'ionisation plus élevé que H3POUSSIÈRE4.
b) FAUX. le HNO3 il a un degré d'ionisation supérieur à 90 %. C'est un acide fort.
c) FAUX.4 a un degré d'ionisation plus élevé que le HNO3 étant donc plus fort que lui.
d) FAUX. le H3POUSSIÈRE4 c'est un acide modéré, car il a un degré d'ionisation compris entre 5% et 50%.
e) CORRECT. le H3BO3 il a un degré d'ionisation inférieur à 5% et est donc un acide faible.
Socles
7. Tapez le nom des bases suivantes :
a) LiOH et Be(OH)2
Hydroxyde de lithium et hydroxyde de béryllium.
Les bases présentées ont une charge fixe et donc la nomenclature est faite comme suit :
LiOH: hydroxyde de lithium.
Soyez (OH)2: hydroxyde de béryllium.
b) CuOH et Cu(OH)2
Hydroxyde cuivreux et hydroxyde cuivrique.
Le cuivre a deux nombres d'oxydation: +1 et +2. Une façon de nommer une base nox variable est la suivante :
| Nox +1 | CuOH | hydroxyde cuivreux |
| Nox +2 | Cu(OH)2 | hydroxyde cuivrique |
c) Sn(OH)2 et Sn(OH)4
Hydroxyde d'étain(II) et hydroxyde d'étain(IV).
L'étain a deux nombres d'oxydation: +2 et +4. La nomenclature d'une base nox variable peut également se faire comme suit :
| Nox +2 | Sn(OH)2 | Hydroxyde d'étain II |
| Nox +4 | Sn(OH)4 | Hydroxyde d'étain IV |
8. (Fiam-SP) Pour lutter contre l'acidité gastrique due à un excès d'acide chlorhydrique, il est d'usage d'ingérer un antiacide. Parmi les substances ci-dessous, présentes dans la vie quotidienne des gens, les plus adaptées pour lutter contre l'acidité sont :
un soda.
b) jus d'orange.
c) de l'eau avec du citron.
d) vinaigre.
e) lait de magnésie.
Alternative correcte: e) lait de magnésie.
Les antiacides sont des substances utilisées pour augmenter le pH de l'estomac, car l'excès d'acide chlorhydrique provoque une diminution du pH et, par conséquent, une augmentation de l'acidité.
Pour lutter contre l'acidité gastrique, il est recommandé d'ingérer un substance à caractère de base, car en réagissant avec l'acide gastrique, il produira une réaction neutralisante, formant du sel et de l'eau.
Selon ce raisonnement, nous devons :
Un tort. La soude ne peut pas être utilisée car elle contient de l'acide carbonique dans sa composition.
b) FAUX. L'orange ne peut pas être utilisée, car elle contient de l'acide citrique dans sa composition.
c) FAUX. Le citron ne peut pas être utilisé, car il contient de l'acide citrique dans sa composition.
d) FAUX. Le vinaigre ne peut pas être utilisé, car il contient de l'acide acétique dans sa composition.
e) CORRECT. Le lait de magnésie doit être utilisé, car il contient une base d'hydroxyde de magnésium dans sa composition.
La réaction de neutralisation formée est:
9. (Osec) Une base forte doit être liée au groupe OH-:
a) un élément très électropositif.
b) un élément très électronégatif.
c) un semi-métal.
d) un métal qui donne 3 électrons.
e) un non-métal.
Alternative correcte: a) un élément très électropositif.
Une base forte est une base qui a un degré élevé de dissociation, c'est-à-dire des ions hydroxyle libres en solution.
L'ion hydroxyle a une charge négative, car il parvient à attirer l'électron vers lui en se dissociant en raison de l'électronégativité de l'oxygène.
Ainsi, un élément très électropositif a la capacité de perdre des électrons et de les céder à l'hydroxyle, restant sous forme cationique en solution.
a) CORRECT. Les éléments très électropositifs tels que les métaux alcalins et les métaux alcalino-terreux forment des bases fortes.
b) FAUX. Un élément plus électronégatif que l'oxygène provoquerait une compétition pour l'électron.
c) FAUX. Un semi-métal a une grande électronégativité.
d) FAUX. L'ion hydroxyle a une charge 1. un métal qui donne 3 électrons formerait une base avec 3 hydroxyles.
Exemple:
e) FAUX. Les bases les plus fortes sont les bases formées avec des métaux.
sels
10. Écrivez le nom des sels suivants :
un-N-A2CO3
Le carbonate de sodium.
Il s'agit d'un type de sel neutre et sa nomenclature est donnée comme suit :
| anion | cation |
| À+ | |
| carbonate | sodium |
| Le carbonate de sodium |
b) KNaSO4
Sulfate de sodium et de potassium.
C'est un type de sel double et sa nomenclature est la même que le sel neutre, et les noms des deux cations sont écrits.
| anion | cations | |
| K+ | À+ | |
| Sulfate | potassium | sodium |
| Sulfate de sodium et de potassium |
c) NaHCO3
Monohydrogénocarbonate de sodium.
Il s'agit d'un type de sel acide et sa nomenclature est donnée comme suit :
| Nombre d'hydrogènes | anion | cation |
| 1 | À+ | |
| Mono | carbonate | sodium |
| Monohydrogénocarbonate de sodium |
Le nom populaire de ce composé est le bicarbonate de sodium.
d) Al(OH)2Cl
Dihydroxychlorure d'aluminium.
Il s'agit d'un type de sel basique et sa nomenclature est donnée comme suit :
| Nombre d'hydroxyles | anion | cation |
| 2 | Cl- | Al3+ |
| Di | chlorure | aluminium |
| Dihydroxychlorure d'aluminium |
Ce composé est également connu sous le nom de chlorure d'aluminium dibasique.
e) CuSO4. 5 heures2O
Sulfate de cuivre pentahydraté.
Il s'agit d'un type de sel hydraté et sa nomenclature est donnée comme suit :
| anion | cation | nombre de molécules d'eau |
| Cul2+ | 5 | |
| Sulfate | cuivre | penta |
| Sulfate de cuivre pentahydraté |
11. Les sels (Unirio) sont également des produits obtenus par réaction de neutralisation totale ou partielle des hydrogènes ionisables des acides avec des bases ou des hydroxydes, selon la réaction générique :
Acide + Base Sel + Eau
Sur la base de cette déclaration, quel est le seul acide qui n'a pas tous ses produits possibles associés ?
a) l'acide chlorhydrique ne produit que le sel de chlorure neutre.
b) nitrique ne produit que le sel neutre de nitrate.
c) phosphorique ne produit que le sel de phosphate neutre.
d) le sulfure peut produire soit le sel sulfure neutre, soit le sel acide, sulfure acide ou sulfure d'hydrogène.
e) sulfurique peut produire soit le sel de sulfate neutre, soit le sel acide, le sulfate acide ou l'hydrogénosulfate.
Alternative incorrecte: c) le phosphore ne produit que le sel de phosphate neutre.
a) CORRECT. L'acide chlorhydrique n'a qu'un seul hydrogène ionisable, qui réagira pour former de l'eau. Le sel sera alors formé par l'anion de l'acide, en l'occurrence le chlorure, et le cation de la base.
Exemples:
b) CORRECT. L'acide nitrique n'a qu'un seul hydrogène ionisable, qui réagira pour former de l'eau. Le sel sera alors formé par l'anion de l'acide, en l'occurrence le nitrate, et le cation de la base.
Exemples:
c) FAUX. L'acide phosphorique a trois hydrogènes ionisables et, par conséquent, il peut subir une ionisation partielle ou totale. Dans ce cas, trois types de sels peuvent être formés :
- Neutralisation totale générant un sel neutre:
- Neutralisation partielle générant un sel acide:
- Neutralisation partielle générant un sel basique:
d) CORRECT. Dans la neutralisation totale, un sel neutre est formé, et dans la neutralisation partielle, un sel acide peut être formé.
- Neutralisation totale:
- Neutralisation partielle:
e) CORRECT. Dans la neutralisation totale, un sel neutre est formé, et dans la neutralisation partielle, un sel acide peut être formé.
- Neutralisation totale:
- Neutralisation partielle:
| JE. À2B4O7.10h2O | LES. sel basique |
| II. Mg(OH)Cl | B. sel double |
| III. NaKSO4 | Ç. sel acide |
| IV. NaHCO3 | RÉ. sel hydraté |
L'association correcte entre eux est :
a) AI, BIII, CIV, DII
b) AII, BIV, CIII, DI
c) AI, BII, CIII, DIV
d) AII, BIII, CIV, DI
Alternative correcte: d) AII, BIII, CIV, DI
| AII. sel basique: Mg(OH)Cl | Il a un hydroxyle dans sa structure. |
| BIII. sel double: NaKSO4 | Il a deux cations métalliques dans sa structure. |
| CIV. sel acide: NaHCO3 | Il a un hydrogène dans sa structure. |
| DI. sel hydraté: Na2B4O7.10h2O | Il a des molécules d'eau dans sa structure. |
Oxydes
13. Écrivez le nom des oxydes suivants :
acier2 et non2O3
Dioxyde de carbone et trioxyde de diazote.
Ces oxydes sont des oxydes moléculaires, car l'oxygène est lié aux non-métaux. La nomenclature de cette classe se fait comme suit :
| nombre d'oxygènes | Nombre de carbones |
| 2 | 1 |
| Dioxyde de monocarbone ou dioxyde de carbone |
| nombre d'oxygènes | Nombre d'azotes |
| 3 | 2 |
| trioxyde de diazote |
b) Al2O3 et sur2O
Oxyde d'aluminium et oxyde de sodium.
Ces oxydes sont des oxydes ioniques, car l'oxygène est lié aux métaux. Les métaux liés à l'oxygène ont une charge fixe. Par conséquent, la nomenclature pour cette classe est faite comme suit :
Al2O3: oxyde d'aluminium
À2O: oxyde de sodium
b) Cu2O et CuO
Oxyde de cuivre I et oxyde de cuivre II.
Ces oxydes sont des oxydes ioniques car l'oxygène est lié à un métal. Le métal lié à l'oxygène a une charge variable. Une façon de nommer cette classe est la suivante :
| Nox +1 | Cul2O | oxyde de cuivre I |
| Nox +2 | CuO | oxyde de cuivre II |
c) FeO et Fe2O3
Oxyde ferreux et oxyde ferrique.
Ces oxydes sont des oxydes ioniques car l'oxygène est lié à un métal. Le métal lié à l'oxygène a une charge variable. La nomenclature d'un oxyde nox variable peut également se faire comme suit :
| Nox +2 | FeO | oxyde ferreux |
| Nox +3 | Foi2O3 | oxyde ferrique |
14. (UEMA) Les atomes neutres d'un certain élément représentatif M ont deux électrons dans leur couche de valence. Les formules correctes pour votre oxyde et votre bromure normaux sont respectivement :
(Données: O= 6A et Br = 7A.)
suis2O et MBr
b) MO2 et MBr2
c) MO et MBr2
d) M2O2 dans2fr
dans2O et MBr2
Alternative correcte: c) MO et MBr2
Les éléments M ont deux électrons dans la couche de valence. Pour se lier à d'autres éléments, il peut perdre ces deux électrons et former le cation M.2+.
L'oxygène appartient à la famille 6A et a besoin de 2 électrons supplémentaires pour acquérir une stabilité avec la configuration électronique d'un gaz noble, comme indiqué par la règle de l'octet.
De même, le brome, qui appartient à la famille 7A, n'a besoin que d'un électron pour avoir 8 électrons dans la couche de valence.
D'après ces informations, nous devons :
Un tort. Pour former le composé M2O et MBr, l'élément M devrait former le cation M+.
b) FAUX. L'oxygène a une charge 2 et non 1 comme représenté lors de la formation du composé MO2.
c) CORRECT. Selon la valence des ions, l'alternative est correcte.
d) FAUX. Le bromure a une charge 1 et non 2 comme indiqué lors de la formation du composé M2Fr.
e) FAUX. Le cation élément a une charge 2+ et non une charge 1+ comme indiqué lors de la formation du composé M.2O.
15. (PUC-MG) Observez les réactions chimiques ci-dessous :
| JE. MgO + H2O |
| II. CO2 + H2O |
| III. K2O + 2HCl |
| IV. SEUL3 + 2NaOH |
L'énoncé incorrect est :
a) Les réactions II et IV font intervenir des oxydes ou anhydrides acides.
b) Les réactions I et III impliquent des oxydes basiques.
c) Le sel produit dans la réaction IV est appelé sulfate de sodium.
d) Le sel produit dans la réaction III est appelé chlorure de potassium.
e) Le caractère basique des oxydes est accentué à mesure que l'oxygène se lie à des éléments plus électronégatifs.
Alternative incorrecte: e) Le caractère basique des oxydes est accentué à mesure que l'oxygène se lie à des éléments plus électronégatifs.
a) CORRECT. Lorsque des oxydes acides tels que le dioxyde de carbone et le trioxyde de soufre réagissent avec l'eau, ils forment un acide en solution.
b) CORRECT. Lors de la réaction avec l'eau, les oxydes basiques tels que l'oxyde de magnésium et l'oxyde de potassium forment une base en solution.
c) CORRECT. À2SEUL4 est la formule du sulfate de sodium.
d) CORRECT. KCl est la formule du chlorure de potassium.
e) FAUX. Le caractère basique des oxydes est accentué à mesure que l'oxygène se lie à plus d'éléments. électropositif, comme les métaux alcalins et alcalino-terreux, car lorsqu'ils réagissent avec l'eau, ils génèrent des bases fortes et lorsqu'ils réagissent avec des acides, ils forment du sel et de l'eau.