La solubilité est la propriété physique des substances de se dissoudre ou non dans un liquide donné.
est appelé soluté, composés chimiques qui se dissolvent dans une autre substance. O solvant c'est la substance dans laquelle le soluté va se dissoudre pour former un nouveau produit.
LES dissolution chimique est le processus de dispersion du soluté dans un solvant, donnant lieu à une solution ou un mélange homogène.
Les solutés peuvent être classés en :
- Soluble: sont les solutés qui se dissolvent dans le solvant.
- Légèrement soluble: sont les solutés difficiles à dissoudre dans le solvant.
- Insoluble: sont les solutés qui ne se dissolvent pas dans le solvant.
Un principe commun de solubilité est: "comme dissoudre comme”. Cela signifie qu'un soluté polaire a tendance à se dissoudre dans un solvant polaire. Il en est de même pour les substances non polaires.
Voir quelques exemples :
- Les hydrocarbures, composés présents dans l'essence, sont apolaires et peu solubles dans l'eau, qui est polaire.
- Les alcools, tels que l'éthanol et le méthanol, sont polaires en raison de la présence d'oxygène dans la chaîne carbonée et, par conséquent, sont solubles dans l'eau.
- Les sels ont une solubilité différente. Ils peuvent être classés en: sel soluble et sel pratiquement insoluble.
Coefficient de solubilité
O coefficient de solubilité (Cs) détermine la capacité maximale du soluté qui se dissout dans une quantité donnée de solvant. Ceci, en fonction des conditions de température.
En résumé, le coefficient de solubilité est la quantité de soluté nécessaire pour saturer une quantité standard de solvant dans une condition donnée.
Par exemple, considérons la situation suivante :
Dans un verre d'eau salée (NaCl), dans un premier temps, le sel disparaît dans l'eau.
Cependant, si plus de sel est ajouté, à un moment donné, il commencera à s'accumuler au fond du verre.
En effet, l'eau, qui est le solvant, a atteint sa limite de solubilité et sa concentration maximale. Cela s'appelle aussi point de saturation.
Le soluté qui reste au fond du récipient et ne se dissout pas est appelé corps inférieur ou précipité.
En relation avec point de saturation, les solutions sont classées en trois types :
- solution insaturée: lorsque la quantité de soluté est inférieure à Cs.
- solution saturée: lorsque la quantité de soluté est exactement la même que Cs. C'est la limite de saturation.
- solution sursaturée: lorsque la quantité de soluté est supérieure à Cs.
Produit de solubilité
Comme nous l'avons vu, la solubilité représente la quantité de soluté dissous dans une solution. O produit de solubilité (Kps) est une constante d'équilibre directement liée à la solubilité.
Son calcul permet de déterminer si une solution est saturée, insaturée ou saturée d'un précipité. Ce calcul est lié à l'équilibre de dissolution et à la concentration d'ions dans la solution.
En effet, le produit de solubilité fait référence à l'équilibre de dissolution des substances ioniques.
en savoir plus sur Soluté et solvant.
Courbe de solubilité
La capacité de solubilité chimique d'une substance soumise à un changement de température n'est pas linéaire. La variation de la capacité de solubilité, en fonction de la température, est appelée courbe de solubilité.
La plupart des substances solides voient leur coefficient de solubilité augmenter avec l'augmentation de la température. Ainsi, la solubilité de chaque matériau se produit proportionnellement, en fonction de la température.
Chaque substance a sa propre courbe de solubilité pour un solvant particulier.
La variation de solubilité est considérée comme linéaire lorsqu'elle n'est pas sous l'influence de la température. Pour connaître la variation, il faut regarder la courbe de solubilité.
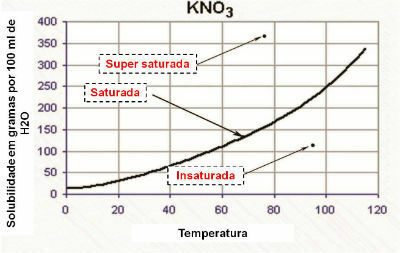
Courbe de solubilité
Dans le graphique, la courbe de solubilité montre que la solution est :
- saturé: lorsque le point est sur la courbe de solubilité.
- insaturé: lorsque le point est en dessous de la courbe de solubilité.
- saturé de manière homogène: lorsque le point est au-dessus de la courbe de solubilité.
Lisez aussi sur Concentration de la solution.
Formule du coefficient de solubilité
La formule pour calculer le coefficient de solubilité est :
Cs = 100. m1/m2
Où:
Cs: coefficient de solubilité
m1: masse de soluté
m2: masse de solvant
Vouloir en savoir davantage? lis Solutions chimiques et Dilution des solutions.
Des exercices
1. (Fuvest-SP) Un chimiste a lu les instructions suivantes dans une procédure décrite dans son guide de laboratoire :
"Dissoudre 5,0 g de Chlorure dans 100 mL d'eau à température ambiante..." .
Parmi les substances ci-dessous, laquelle est mentionnée dans le texte ?
a) Cl2.
b) CCI4.
c) NaClO.
d) NH4Cl.
e) AgCl.
d) NH4Cl.
2. (UFRGS-RS) Un certain sel a une solubilité dans l'eau égale à 135g/L à 25°C. En dissolvant complètement 150 g de ce sel dans un litre d'eau, à 40°C, et en refroidissant lentement le système à 25°C, on obtient un système homogène dont la solution sera :
a) dilué.
b) concentré.
c) insaturé.
d) saturé.
e) sursaturé.
e) sursaturé.
3. (Mackenzie-SP) Un exemple typique de solution sursaturée est :
L'eau minérale.
b) sérum maison.
c) soude dans un récipient fermé.
d) alcool 46° GL.
e) vinaigre.
c) soude dans un récipient fermé.
4. (PUC-RJ) Notez la figure ci-dessous, qui représente la solubilité, en g pour 100 g de H2O, de 3 sels inorganiques dans une plage de température donnée :
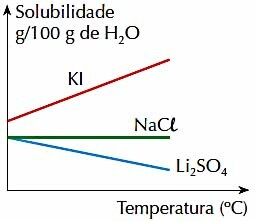
Vérifiez la bonne déclaration :
a) La solubilité des 3 sels augmente avec la température.
b) L'augmentation de la température favorise la solubilisation de Li2SEUL4.
c) La solubilité du KI est supérieure aux solubilités des autres sels, dans la plage de températures indiquée.
d) La solubilité du NaCl varie avec la température.
e) La solubilité de 2 sels diminue avec la température.
c) La solubilité du KI est supérieure aux solubilités des autres sels, dans la plage de températures indiquée.