Les propriétés colligatives impliquent des études sur la propriétés physiques des solutions, plus précisément d'un solvant en présence d'un soluté.
Bien que pas à notre connaissance, les propriétés colligatives sont largement utilisées dans les processus industriels et même dans diverses situations quotidiennes.
Liés à ces propriétés sont les constantes physiques, par exemple, la température d'ébullition ou de fusion de certaines substances.
A titre d'exemple, on peut citer le procédé de l'industrie automobile, comme l'ajout d'additifs aux radiateurs de voiture. Cela explique pourquoi dans les endroits plus froids, l'eau dans le radiateur ne gèle pas.
Les procédés réalisés avec des aliments, comme le salage de viandes ou encore d'aliments saturés de sucre, empêchent la détérioration et la prolifération des organismes.
De plus, le dessalement de l'eau (désalinisation) ainsi que l'épandage de sel sur la neige par endroits où l'hiver est très rigoureux, corroborent l'importance de connaître les effets colligatifs sur solutions.
Vous voulez en savoir plus sur les concepts liés aux propriétés colligatives? Lire les articles :
- États physiques de l'eau
- Point de fusion et point d'ébullition
- Désalinisation de l'eau
- Séparation des mélanges
Solvant et soluté
Tout d'abord, nous devons prêter attention aux concepts de solvant et soluté, les deux composants d'une solution :
- Solvant: substance qui se dissout.
- Soluté: substance dissoute.
A titre d'exemple, nous pouvons penser à une solution d'eau avec du sel, où l'eau représente le solvant et le sel, le soluté.
Vouloir en savoir davantage? Lire aussi Solubilité.
Effets colligatifs: types de propriétés colligatives
Les effets colligatifs sont associés à des phénomènes qui se produisent avec les solutés et les solvants d'une solution, classés comme :
Effet tonométrique
La tonoscopie, également appelée tonométrie, est un phénomène qui s'observe lorsque la diminution de la pression de vapeur maximale d'un liquide (solvant).
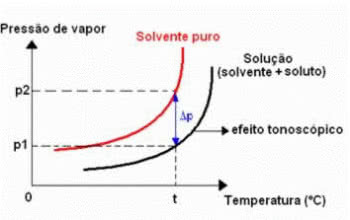
Tableau des effets tonométriques
Cela se produit par la dissolution d'un soluté non volatil. Par conséquent, le soluté diminue la capacité d'évaporation du solvant.
Ce type d'effet colligatif peut être calculé par l'expression suivante :
ΔP =p0 -P
Où,
ΔP: abaissement absolu de la pression de vapeur maximale de la solution
P0: pression de vapeur maximale du liquide pur, à la température t
P: pression de vapeur maximale de la solution, à la température t
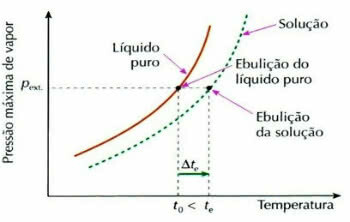
Effet ébuliométrique
L'ébullioscopie, également appelée ébulliométrie, est un phénomène qui contribue à la augmentation de la variation de température d'un liquide pendant le processus d'ébullition.
Graphique de l'effet ébuliométrique
Cela se produit par la dissolution d'un soluté non volatil, par exemple, lorsque nous ajoutons du sucre à l'eau sur le point de bouillir, la température d'ébullition du liquide augmente.
L'effet dit ébulliométrique (ou ébuliscopique) se calcule par l'expression suivante :
tet = tet – t0
Où,
tet: élévation de la température d'ébullition de la solution
tet: température d'ébullition initiale de la solution
t0: température d'ébullition du liquide pur
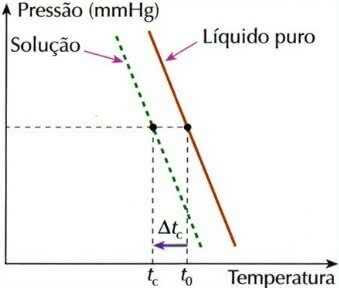
Effet cryométrique
La cryoscopie, également appelée cryométrie, est un processus dans lequel le baisse de la température de congélationd'une solution.
Graphique d'effet cryométrique
En effet, lorsqu'un soluté non volatil est dissous dans un liquide, la température de congélation du liquide diminue.
Un exemple de cryoscopie est les additifs antigel qui sont placés dans les radiateurs de voiture dans des endroits où la température est très basse. Ce processus empêche le gel de l'eau, prolongeant ainsi la durée de vie des moteurs de voiture.
De plus, le sel répandu dans les rues dans les endroits où l'hiver est très froid, empêche l'accumulation de glace sur les routes.
Pour calculer cet effet colligatif, la formule suivante est utilisée :
tç = t0 – tç
Où,
tç: abaissement de la température de congélation de la solution
t0: température de congélation du solvant pur
tç: température de congélation initiale du solvant dans la solution
Découvrez une expérience sur cette propriété à l'adresse: Expériences de chimie
La loi de Raoult
La loi dite de Raoult a été proposée par le chimiste français François-Marie Raoult (1830-1901).
Il a étudié les effets colligatifs (tonométriques, ébuliométriques et cryométriques), aidant dans les études des masses moléculaires des substances chimiques.
En étudiant les phénomènes associés à la fonte et à l'ébullition de l'eau, il est arrivé à la conclusion que: en dissolvant 1 mole de tout soluté non volatil et non ionique dans 1 kg de solvant, vous avez toujours le même tonométrique, ébuliométrique ou cryométrique.
Ainsi, la loi de Raoult peut être exprimée comme suit :
“Dans une solution de soluté non volatile et non ionique, l'effet colligatif est proportionnel à la molalité de la solution.”.
Elle peut s'exprimer ainsi :
Psolution = xsolvant. Psolvant pur
Lisez aussi sur le Nombre de moles et masse molaire.
osmométrie
L'osmométrie est un type de propriété colligative qui est liée à pression osmotique des solutions.
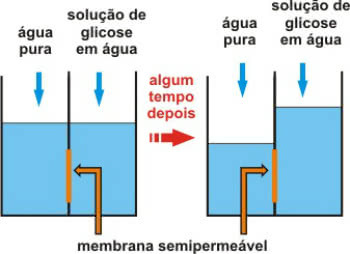
Rappelons que l'osmose est un processus physico-chimique qui implique le passage de l'eau d'un milieu moins concentré (hypotonique) à un milieu plus concentré (hypertonique).
Cela se fait à travers une membrane semi-perméable, qui ne permet que le passage de l'eau.
Action membranaire semi-perméable après un certain temps
L'appel pression osmotique c'est la pression qui permet à l'eau de se déplacer. Autrement dit, c'est la pression exercée sur la solution qui empêche sa dilution en faisant passer le solvant pur à travers la membrane semi-perméable.
Ainsi, l'osmométrie est l'étude et la mesure de la pression osmotique dans les solutions.
Notez que dans la technique de dessalement de l'eau (élimination du sel) le processus appelé osmose inverse.
En savoir plus sur Osmose.
Lois de l'osmométrie
Le physicien et chimiste néerlandais Jacobus Henricus Van't Hoff (1852-1911) est à l'origine de l'hypothèse de deux lois associées à l'osmométrie.
La première loi peut s'exprimer ainsi :
“A température constante, la pression osmotique est directement proportionnelle à la molarité de la solution.”
Dans la deuxième loi postulée par lui, nous avons l'énoncé suivant :
“A molarité constante, la pression osmotique est directement proportionnelle à la température absolue de la solution.”
Par conséquent, pour calculer la pression osmotique des solutions moléculaires et diluées, la formule est utilisée :
= TRM
étant,
π: pression osmotique de la solution (atm)
M: molarité de la solution (mol/L)
R: constante universelle des gaz parfaits = 0,082 atm. L/mol. K
T: température absolue de la solution (K)
Lire aussi Molarité.
Exercices d'examen d'entrée avec rétroaction
1. En comparant deux casseroles, simultanément sur deux brûleurs identiques sur le même poêle, on constate que la pression de gaz dans l'eau bouillante d'un autocuiseur fermé est supérieur à celui de l'eau bouillante d'un autocuiseur ouvert.
Dans cette situation, et s'ils contiennent exactement les mêmes quantités de tous les ingrédients, on peut d'affirmer que, par rapport à ce qui se passe dans la casserole ouverte, le temps de cuisson dans l'autocuiseur fermé sera :
a) plus bas, car la température d'ébullition sera plus basse.
b) plus bas, car la température d'ébullition sera plus élevée.
c) plus petite, car la température d'ébullition ne varie pas avec la pression.
d) égale, car la température d'ébullition est indépendante de la pression.
e) plus élevé, car la pression sera plus élevée.
Alternative b
2. (UFRN) Dans les lieux d'hiver rigoureux, il est d'usage d'ajouter une certaine quantité d'éthylène glycol à l'eau des radiateurs de voiture. L'utilisation d'une solution au lieu de l'eau comme liquide de refroidissement est due au fait que la solution a :
a) chaleur de fusion plus faible.
b) point de congélation inférieur.
c) point de congélation plus élevé.
d) chaleur de fusion plus élevée.
Alternative b
3. (Vunesp) L'un des moyens de guérir les blessures, selon la croyance populaire, est de mettre du sucre ou de la poudre de café dessus. La propriété colligative qui explique le mieux l'élimination du liquide, par la procédure décrite, favorisant la cicatrisation, est étudiée par :
a) osmométrie.
b) cryoscopie.
c) endoscopie.
d) la tonoscopie.
e) ébulliométrie.
Alternative à
4. (UFMG) Dans un congélateur, il existe cinq façons qui contiennent différents liquides, pour faire de la glace et des sucettes glacées au citron. Si les moules sont placés au congélateur en même temps et sont initialement à la même température, le moule contenant 500 ml de: sera d'abord congelé
a) de l'eau pure.
b) solution, dans l'eau, contenant 50 ml de jus de citron.
c) solution, dans l'eau, contenant 100 ml de jus de citron.
d) solution, dans l'eau, contenant 50 ml de jus de citron et 50 g de sucre.
e) solution, dans l'eau, contenant 100 ml de jus de citron et 50 g de sucre.
Alternative à
5. (Cesgranrio-RJ) Le point de fusion d'une substance x a été déterminé, trouvant une valeur inférieure au tableau pour cette substance. Cela pourrait signifier que :
a) la quantité de substance utilisée dans la détermination était inférieure à ce qui était nécessaire.
b) la quantité de substance utilisée dans la détermination était supérieure à ce qui était nécessaire.
c) une partie de la substance n'a pas fondu.
d) la substance contient des impuretés.
e) la substance est pure à 100 %.
Alternative

