L'isomérie chimique est un phénomène observé lorsque deux substances organiques ou plus ont la même formule moléculaire, mais une structure moléculaire et des propriétés différentes.
Les substances chimiques présentant ces caractéristiques sont appelées isomères.
Le terme est dérivé des mots grecs iso = égal et simple = parties, c'est-à-dire des parties égales.
Il existe différents types d'isomérie :
- isomère plat: Les composés sont identifiés par des formules structurelles plates. Il est divisé en isomérie en chaîne, isomérie de fonction, isomérie de position, isomérie de compensation et isomérie de tautomérie.
- isomère de l'espace: La structure moléculaire des composés a différentes structures spatiales. Il est divisé en isomérie géométrique et optique.
isomère plat
À isomérie plate ou isomérie constitutionnelle, la structure moléculaire des substances organiques est plate.
Les composés qui présentent cette caractéristique sont appelés isomères plats.
isomère de chaîne
L'isomérie en chaîne se produit lorsque les atomes de carbone ont des chaînes différentes et la même fonction chimique.
Exemples:
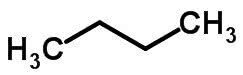
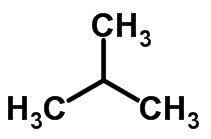
Isomérie de fonction
L'isomérie de fonction se produit lorsque deux ou plusieurs composés ont des fonctions chimiques différentes et la même formule moléculaire.
Exemples: Ce cas est commun entre les aldéhydes et les cétones.
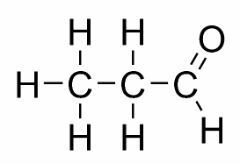
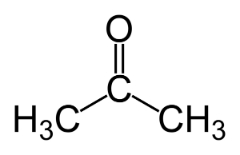
Isomère de position
L'isomérie de position se produit lorsque les composés sont différenciés par différentes positions d'insaturation, de ramification ou de groupe fonctionnel dans la chaîne carbonée. Dans ce cas, les isomères ont la même fonction chimique.
Exemples:

isomère de compensation
L'isomérie de compensation ou le métamérisme se produit dans des composés ayant la même fonction chimique qui diffèrent par la position des hétéroatomes.
Exemples:

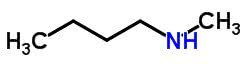
Tautomérie
La tautomérie ou isomérie dynamique peut être considérée comme un cas particulier d'isomérie fonctionnelle. Dans ce cas, un isomère peut se transformer en un autre en changeant la position d'un élément dans la chaîne.
Exemples:

isomère de l'espace
LES isomérie spatiale, également appelée stéréoisomérie, se produit lorsque deux composés ont la même formule moléculaire et des formules structurelles différentes.
Dans ce type d'isomérie, les atomes sont répartis de la même manière, mais occupent des positions différentes dans l'espace.
isomère géométrique
LES isomérie géométrique ou cis-trans se produit dans des chaînes ouvertes insaturées et également dans des composés cycliques. Pour ce faire, les ligands carbonés doivent être différents.

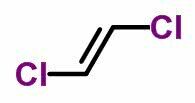
- Lorsque les mêmes ligands sont du même côté, la nomenclature des isomères reçoit le préfixe cis.
- Lorsque les mêmes ligands sont sur des côtés opposés, la nomenclature reçoit le préfixe trans.
L'IUPAC (Union internationale de chimie pure et appliquée) recommande qu'au lieu de cis et trans, les lettres Z et E soient utilisées comme préfixe.
C'est parce que Z est la première lettre du mot allemand zusammen, qui signifie "ensemble". Et c'est la première lettre du mot allemand entegegen, ce qui signifie "en face".
isomère optique
LES isomérie optique est démontrée par des composés optiquement actifs. Cela se produit lorsqu'une substance est causée par la déviation angulaire dans le plan de la lumière polarisée.
- Lorsqu'une substance courbe la lumière optique vers la droite, elle est appelée droitier.
- Lorsqu'une substance courbe la lumière optique vers la gauche, la substance est appelée lévogyre.
Une substance peut également exister sous deux formes optiquement actives, la dextogyre et la lévogyre. Dans ce cas, on l'appelle énantiomère.
Pour qu'un composé carboné soit optiquement actif, il doit être chiral. Cela signifie que leurs ligands ne peuvent pas se chevaucher, étant asymétriques.
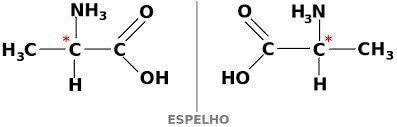
À son tour, si un composé a les formes dextrogyre et lévogyre à parts égales, ils sont appelés mélanges racémiques. L'activité optique des mélanges racémiques est inactive.
A lire aussi :
- Carbone
- Chimie organique
- Formule moléculaire
- formule structurelle
Des exercices
1. (Mackenzie 2012) Numéroter la colonne B, qui contient les composés organiques, en les associant à la colonne A, selon le type d'isomérie que présente chaque molécule organique.
Colonne A
1. isomère de compensation
2. isomère géométrique
3. isomère de chaîne
4. isomère optique
Colonne B
( ) cyclopropane
( ) éthoxy-éthane
( ) bromo-chloro-fluoro-méthane
( ) 1,2-dichloro-éthène
La séquence correcte de nombres dans la colonne B, de haut en bas, est
a) 2 - 1 - 4 - 3.
b) 3 - 1 - 4 - 2.
c) 1 - 2 - 3 - 4.
d) 3 - 4 - 1 - 2.
e) 4 - 1 - 3 - 2.
Variante b) 3 - 1 - 4 - 2.
2. (Uerj) L'isomérie est le phénomène qui se caractérise par le fait qu'une même formule moléculaire représente des structures différentes.
Considérant l'isomérie structurelle plate pour la formule moléculaire C4H8, on peut identifier les isomères des types suivants :
a) chaîne et position
b) chaîne et fonction
c) fonction et rémunération
d) poste et rémunération
Alternative a) chaîne et position
3. (OSEC) La propanone et l'isopropénol illustrent un cas d'isomérie :
a) de la métaméria
b) de fonction
c) de tautomérie
d) cis-tran
e) chaîne
Alternative c) de tautomérie
Voir aussi: Exercices sur l'isomérie plate

