La formule structurelle est le schéma qui indique la structure, c'est-à-dire la disposition des atomes qui composent les éléments chimiques, ainsi que la connexion entre eux. Il peut être représenté de différentes manières: plat, condensé ou électronique.
Parmi les facteurs qui conditionnent les structures utilisées, le nombre d'électrons dans la couche de valence en fait partie.
Formule forfaitaire
La formule plate utilise des tirets pour représenter les liaisons covalentes, qui peuvent être simples, doubles ou triples et représentées de la manière suivante :
– connexion simple (quand 2 électrons sont partagés)
= double liaison (quand 4 électrons sont partagés)
triple lien (quand 6 électrons sont partagés)
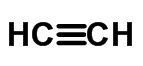
Formule condensée ou simplifiée
Dans la formule structurelle condensée, les liaisons ne sont pas représentées.
Dans sa représentation, le nombre d'atomes de chaque élément est indiqué de manière condensée, c'est-à-dire simplifiée :
H3C CH2 le CH2 CH3
Formule condensée linéaire
La formule linéaire condensée utilise des lignes en zigzag, aux sommets desquelles les carbones sont représentés :
Formule électronique ou Lewis
La formule électronique, également appelée formule de Lewis, est représentée par des points.
A travers ces points, les quantités d'électrons présents dans les couches de valence sont indiquées :
H: H
Et la formule moléculaire ?
LES formule moléculaire, sans faire référence à sa structure, indique le nombre d'éléments qui composent un molécule. En plus d'indiquer le nombre d'atomes présents dans chaque élément et leurs proportions.
Il peut être obtenu par la formule minimale ou empirique et la formule en pourcentage ou centésimale.
Lire aussi Isomérie et Couche de Valence.
Exercices résolus
1. (Vunesp-2000) Écrivez la formule développée et donnez le nom officiel :
a) une cétone saturée à chaîne carbonée ramifiée avec un total de 7 atomes de carbone.
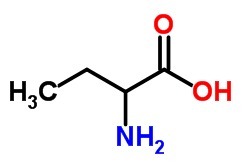
b) un acide aminé, avec 4 atomes de carbone.
Le)

B)
2. (FGV-2005) L'aspartame est un édulcorant artificiel qui a été accidentellement découvert en 1965 par un chimiste négligent, qui léchait ses doigts sales et les sentait sucrés.
Ces habitudes non hygiéniques ne sont pas recommandées, car de nombreuses substances en quantités infimes sont hautement toxiques.
La formule structurelle de l'aspartame est indiquée ci-dessous :

D'après la formule développée de l'aspartame, il apparaît qu'il y a
a) 13 atomes de carbone par molécule.
b) 1 fonction éther.
c) 1 dipeptide
d) 2 atomes de carbone tertiaire
e) seulement 1 atome de carbone asymétrique.
Alternative c: 1 dipeptide
Pour continuer à tester vos connaissances, consultez également ces listes d'exercices :
- Exercices sur les Hydrocarbures
- Exercices sur la chimie organique
- Exercices sur l'isomérie plate

