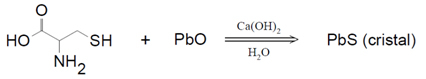Ce qui met en évidence une réaction, c'est la transformation qui se produit dans les substances par rapport à leur état initial, ces modifications dépendent du type de réaction que vont subir les réactifs.
Il existe plusieurs critères pour classer les réactions chimiques, l'un d'eux concerne le nombre de substances qui réagissent (réactifs) et le nombre de substances produites (produits). Pour mieux illustrer, nous utiliserons les lettres: LES, B, Ç, X, Oui.
Réaction de synthèse ou d'addition: sont celles dont deux ou plusieurs substances sont à l'origine d'un même produit.
A + B → Ç
Exemple de cette réaction: lorsque le magnésium réagit avec l'oxygène de l'air :
2Mg(s) + 1O2(g) → 2MgO(s)
Cette réaction est présente dans les flashs photographiques jetables et les fusées de signalisation.
Analyse ou réaction de décomposition: dans cette réaction, une seule substance génère deux ou plusieurs produits.
LES → B + C
Certaines réactions portent des noms particuliers :
Électrolyse: les substances se décomposent par le passage du courant électrique.
Photolyse: décomposition chimique par la lumière.
Pyrolyse: décomposition par l'action de la chaleur et du feu.
Exemple: Les airbags sont des dispositifs de sécurité présents dans de nombreuses voitures. Lorsque nous déclenchons cet appareil, la décomposition rapide du composé de sodium NaN3(s) provient N2(g) qui gonfle les airbags. Voir la réaction :
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
2 NaN3(s) → 3 N2(g) + 2 Na(s)
Réaction d'échange ou de déplacement simple: se produit lorsqu'une substance simple réagit avec un composé, créant de nouvelles substances: une simple et une composée.
A + XY → Y+X
Exemple: Lorsqu'une feuille de zinc est introduite dans une solution aqueuse d'acide chlorhydrique, du chlorure de zinc se forme et de l'hydrogène gazeux se dégage.
Zn (s) + 2 HCl (aq) → ZnCl2(aq) + H2 (g)
Notez que le zinc a déplacé l'hydrogène, d'où le nom de « réaction de déplacement ».
réaction d'échange double: deux réactifs réagissent en formant deux produits, c'est-à-dire que si deux substances composées réagissent en donnant naissance à de nouvelles substances composées, elles reçoivent ce nom.
AB + XY → Y+XB
Exemple: La réaction entre l'acide sulfurique et l'hydroxyde de baryum produit de l'eau et du sulfate de baryum.
H2SEUL4 (aq) + Ba (OH)2(aq) → 2H2O(1) + BaSO4(s)
Le produit sulfate de baryum: BaSO4(s) est un sel blanc insoluble.
Par Líria Alves
Diplômé en Chimie
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
SOUZA, Líria Alves de. "Types de réactions chimiques"; École du Brésil. Disponible en: https://brasilescola.uol.com.br/quimica/tipos-reacoes-quimicas.htm. Consulté le 27 juin 2021.