Les propriétés périodiques des éléments chimiques sont les caractéristiques qu'ils possèdent.
Notez que les éléments chimiques du tableau périodique ont un emplacement spécifique qui varie en fonction des propriétés périodiques qu'ils présentent. Ils sont classés par ordre croissant de numéro atomique.
Selon la loi de Moseley :
“De nombreuses propriétés physiques et chimiques des éléments varient périodiquement dans la séquence des numéros atomiques des éléments.”
Principales propriétés périodiques
rayon atomique
Liée à la taille des atomes, cette propriété est définie par la distance entre les centres des noyaux de deux atomes d'un même élément.
Par conséquent, la rayon atomique correspond à la moitié de la distance entre les noyaux de deux atomes voisins, s'exprimant ainsi :
r = d/2
Où:
r: foudre
ré: distance internucléaire
Il se mesure en picomètres (après-midi). Cette mesure est un sous-multiple du mètre :
13h = 10-12 m
Dans le tableau périodique, le rayon atomique augmente de haut en bas en position verticale. Sur l'horizontale, elles augmentent de droite à gauche.
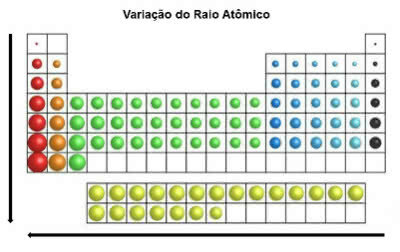
Variation du rayon atomique
L'élément chimique qui a le plus grand rayon atomique est le Césium (Cs).
Volume atomique
Cette propriété périodique indique le volume occupé par 1 mol de l'élément à l'état solide.
Il est à noter que le volume atomique n'est pas le volume de 1 atome, mais un ensemble de 6,02. 1023 atomes (valeur 1 mol)
Le volume atomique d'un atome est défini non seulement par le volume de chaque atome, mais aussi par l'espacement qui existe entre ces atomes.
Dans le tableau périodique, les valeurs de volume atomique augmentent de haut en bas (vertical) et du centre au bord (horizontal).

Variation du volume atomique
Pour calculer le volume atomique, la formule suivante est utilisée :
V = m/j
Où:
V: volume atomique
m: masse de 6,02. 1023 éléments atomes
ré: densité d'éléments à l'état solide
Densité absolue
LES densité absolue, également appelée « masse spécifique », est une propriété périodique qui détermine la relation entre la masse (m) d'une substance et le volume (v) occupé par cette masse.
Il est calculé par la formule suivante :
d = m/v
Où:
ré: densité
m: Pâtes
v: le volume
Dans le tableau périodique, les valeurs de densité augmentent de haut en bas (vertical) et des bords au centre (horizontal).
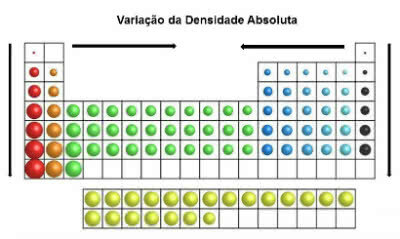
Variation de densité absolue
Ainsi, les éléments les plus denses se trouvent au centre et en bas du tableau :
Osmium (Os): d= 22,5 g/cm3
Iridium (Ir): d = 22,4 g/cm3
Point de fusion et point d'ébullition
Une autre propriété périodique importante est liée aux températures auxquelles les éléments entrent en fondre et bouillir.
Le point de fusion (PM) est la température à laquelle la matière passe de la phase solide à la phase liquide. Le point d'ébullition (PE) est la température à laquelle la matière passe de la phase liquide à la phase gazeuse.
Dans le tableau périodique, les valeurs de PF et PE varient selon les côtés qui sont positionnés dans le tableau.
Verticalement et sur le côté gauche de la table, ils augmentent de bas en haut. Sur le côté droit, ils augmentent de haut en bas. Dans le sens horizontal, ils s'étendent des extrémités vers le centre.

Variation du point de fusion et d'ébullition
Affinité électronique
Aussi appelée « électroaffinité », c'est l'énergie minimale requise par un élément chimique pour retirer un électron d'un anion.
C'est le affinité électronique indique la quantité d'énergie libérée lorsqu'un électron est reçu par un atome.
A noter que cet atome instable est seul et à l'état gazeux. Avec cette propriété, il acquiert une stabilité lorsqu'il reçoit l'électron.
Contrairement au rayon atomique, l'électroaffinité des éléments du tableau périodique croît de gauche à droite, horizontalement. Dans le sens vertical, il augmente de bas en haut.
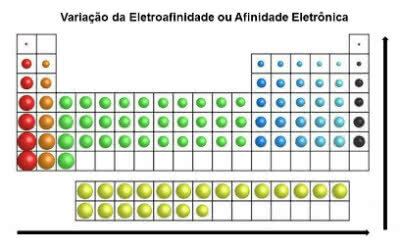
Variation d'affinité électronique
L'élément chimique qui a la plus grande affinité électronique est le chlore (Cl), avec une valeur de 349 KJ/mol.
Énergie d'ionisation
Aussi appelé "potentiel d'ionisation», cette propriété est contraire à celle de l'affinité électronique.
C'est l'énergie minimale requise par un élément chimique pour retirer un électron d'un atome neutre.
Ainsi, cette propriété périodique indique la quantité d'énergie nécessaire pour transférer l'électron d'un atome dans un état fondamental.
L'état fondamental d'un atome signifie que son nombre de protons est égal à son nombre d'électrons (p+ = et-).
Ainsi, après avoir retiré un électron de l'atome, celui-ci est ionisé. C'est-à-dire qu'il obtient plus de protons que d'électrons et devient donc un cation.
Dans le tableau périodique, l'énergie d'ionisation est contraire à celle du rayon atomique. Il augmente donc de gauche à droite et de bas en haut.
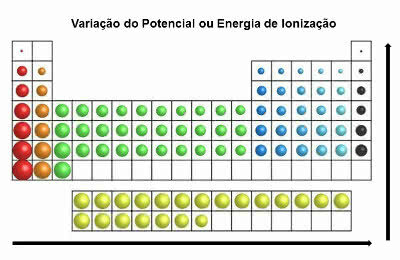
Variation d'énergie d'ionisation
Les éléments qui ont le plus grand potentiel d'ionisation sont le Fluor (F) et le Chlore (Cl).
électronégativité
Propriété des atomes d'éléments qui ont tendance à recevoir des électrons dans une liaison chimique.
Il se produit dans des liaisons covalentes au moment du partage de paires d'électrons. Lorsqu'ils reçoivent des électrons, les atomes se retrouvent avec une charge négative (anion).
N'oubliez pas que ceci est considéré comme la propriété la plus importante du tableau périodique. En effet, l'électronégativité induit le comportement des atomes, à partir desquels se forment les molécules.
Dans le tableau périodique, le électronégativité augmente de gauche à droite (horizontalement) et de bas en haut (verticale)
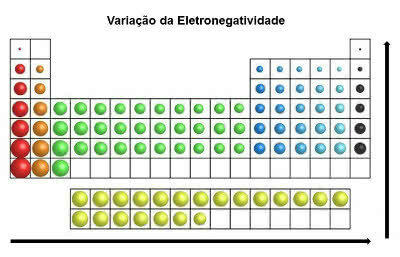
Variation d'électronégativité
Ainsi, l'élément le plus électronégatif du tableau périodique est le fluor (F). En revanche, le Césium (Cs) et le Francium (Fr) sont les éléments les moins électronégatifs.
électropositivité
Contrairement à l'électronégativité, cette propriété des atomes élémentaires indique des tendances à perdre (ou à abandonner) des électrons dans une liaison chimique.
En perdant des électrons, les atomes des éléments reçoivent une charge positive, formant ainsi un cation.
Dans le même sens que le rayon atomique et contrairement à l'électronégativité, dans le tableau périodique a électropositivité augmente de droite à gauche (horizontal) et de haut en bas (vertical).
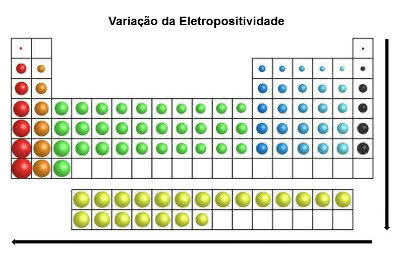
Variation d'électropositivité
Les éléments chimiques ayant l'électropositivité la plus élevée sont les métaux, et pour cette raison, cette propriété est également appelée « caractère métallique ». L'élément le plus électropositif est le Francium (Fr) avec une tendance maximale à l'oxydation.
Attention!
Toi "gaz nobles” sont des éléments inertes, car ils n'effectuent pas de liaisons chimiques et donnent ou reçoivent à peine des électrons. De plus, ils ont des difficultés à réagir avec d'autres éléments.
Par conséquent, l'électronégativité et l'électropositivité de ces éléments ne sont pas prises en compte.
A lire aussi :
- Liaisons chimiques
- Histoire du tableau périodique
- Familles de tableaux périodiques
Propriétés apériodiques
En plus des propriétés périodiques, nous avons des propriétés apériodiques. Dans ce cas, les valeurs augmentent ou diminuent avec le nombre atomique des éléments.
Ils reçoivent ce nom, car ils n'obéissent pas à leur position sur le tableau périodique comme les périodiques. C'est-à-dire qu'ils ne sont pas répétés à des périodes régulières.
Les principales propriétés apériodiques sont :
- Masse atomique: Cette propriété augmente à mesure que le numéro atomique augmente.
- Chaleur spécifique: cette propriété diminue avec l'augmentation du numéro atomique. N'oubliez pas que la chaleur spécifique est la quantité de chaleur nécessaire pour augmenter la température de 1 °C de 1 g de l'élément.
Exercices d'examen d'entrée avec rétroaction
1. (PUC-RJ) Considérez les déclarations sur les éléments du groupe IA dans le tableau périodique
JE. Ils sont appelés métaux alcalins.
II. Ses rayons atomiques croissent avec le numéro atomique.
III. Son potentiel d'ionisation augmente avec le numéro atomique.
IV: Son caractère métallique augmente avec le numéro atomique.
Parmi les affirmations, sont vraies :
a) I et II
b) III et IV
c) I, II et IV
d) II, III et IV
e) I, II, III et IV
Alternative c
2. (UFMG) En comparant le chlore et le sodium, les deux éléments chimiques qui forment le sel de table, on peut dire que le chlore :
a) est plus dense.
b) est moins volatile.
c) a un plus grand caractère métallique.
d) a une énergie d'ionisation plus faible.
e) a un rayon atomique plus petit.
Alternative et
3. (UFC-CE) L'effet photoélectrique consiste en l'émission d'électrons à partir de surfaces métalliques, par l'incidence de la lumière de fréquence appropriée. Ce phénomène est directement influencé par le potentiel d'ionisation des métaux, qui ont été largement utilisés dans la fabrication de dispositifs photoélectroniques, tels que: photocellules d'éclairage public, caméras photographique etc... Sur la base de la variation du potentiel d'ionisation des éléments du tableau périodique, marquez l'alternative qui contient le métal le plus susceptible de présenter l'effet photoélectrique.
a) Fe
b) Hg
c) Cs
d) mg
e) Ca
Alternative c
Vérifiez les questions d'examen d'entrée avec une résolution commentée dans Exercices sur le tableau périodique et des questions inédites sur le sujet dans Exercices sur l'organisation du tableau périodique.
A lire aussi :
- Tableau périodique
- Diffusion électronique
- Éléments chimiques
- Forces intermoléculaires