Le diagramme de Pauling, également connu sous le nom de diagramme énergétique, est le représentation de la distribution électronique à travers des sous-niveaux de puissance.
Grâce à ce schéma, le chimiste Linus Carl Pauling (1901-1994) a suggéré quelque chose au-delà de ce qui était déjà connu concernant la distribution des électrons des atomes d'éléments chimiques.
Pour améliorer l'humeur, Pauling a proposé les sous-niveaux d'énergie. Grâce à eux, il serait possible d'arranger les électrons du plus bas au plus haut niveau d'énergie d'un atome dans son état fondamental.
Distribution électronique par Linus Pauling
Selon le modèle proposé par Pauling, l'électrosphère est divisée en 7 couches électroniques (K, L, M, N, O, P et Q) autour du noyau atomique, dont chacun autorise un nombre maximum d'électrons, qui sont respectivement de 2, 8, 18, 32, 32,18 et 8 .
À distribution électronique les sous-niveaux d'énergie, montrant d'abord l'électron d'énergie la plus faible jusqu'à atteindre l'électron d'énergie la plus élevée.
| Couches électroniques | Nombre maximal d'électrons | Sous-niveaux d'énergie | ||||
|---|---|---|---|---|---|---|
| 1 | K | 2 et- | 1s2 | |||
| 2 | L | 8 et- | 2s2 | 2p6 | ||
| 3 | M | 18 et- | 3s2 | 3p6 | 3d10 | |
| 4 | N | 32 et- | 4s2 | 4p6 | 4d10 | 4f14 |
| 5 | O | 32 et- | 5s2 | 5p6 | 5j10 | 5f14 |
| 6 | P | 18 et- | 6s2 | 6p6 | 6d10 | |
| 7 | Q | 8 et- | 7s2 | 7p6 |
La couche K n'a qu'un seul sous-niveau(x), la couche L a deux sous-niveaux (s et p), la couche m a trois sous-niveaux (s, p et d) et ainsi de suite.
Les sous-niveaux s autorisent jusqu'à 2 électrons, tandis que les sous-niveaux p autorisent jusqu'à 6 électrons. Ensuite, les sous-niveaux d autorisent jusqu'à 10 électrons, tandis que les sous-niveaux f autorisent jusqu'à 14 électrons.
Notez que la somme des électrons qui se sont comportés dans chaque sous-niveau par couche électronique donne le nombre maximum d'électrons dans chacune des 7 couches.
K: s2 = 2
L et Q: s2 + p6 = 8
M et P: s2 + p6 + d10 = 18
N et O: oui2 + p6 + d10 + f14= 32
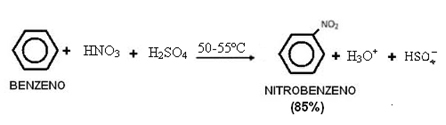
C'est alors que Pauling découvre la ordre croissant d'énergie:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5j10 6p6 7s2 5f14 6d10 7p6
A partir de là, les flèches diagonales apparaissent dans le schéma pour faire la répartition électronique des éléments :
 Diagramme de Pauling
Diagramme de Pauling
Exemple de distribution électronique du phosphore 15P :
1s2 2s2 2p6 3s2 3p3
comme jusqu'à 3s2 nous avions déjà un total de 12 électrons (2 + 2 + 6 + 2), nous n'avons besoin que de 3 électrons supplémentaires du sous-niveau 3p6.
Ainsi, nous pouvons obtenir la quantité d'électrons requise, tant qu'elle n'est pas supérieure à 6, qui est le nombre maximum que le sous-niveau 3p6 se comporte.
Lire aussi Couche de Valence et Nombres quantiques.
Exercices résolus sur la distribution électronique
question 1
(Unirio) « Les implants dentaires sont plus sûrs au Brésil et répondent déjà aux normes de qualité internationales. Le grand saut de qualité a eu lieu dans le processus de fabrication des vis et des broches en titane, qui constituent les prothèses. Fabriquées avec des alliages de titane, ces prothèses sont utilisées pour fixer des couronnes dentaires, des appareils orthodontiques et des prothèses dentaires, dans les os de la mâchoire et de la mâchoire. (Jornal do Brasil, octobre 1996.)
Considérant que le numéro atomique du titane est 22, sa configuration électronique sera :
a) 1s2 2s2 2p6 3s2 3p3
b) 1s2 2s2 2p6 3s2 3p5
c) 1s2 2s2 2p6 3s2 3p6 4s2
d) 1s2 2s2 2p6 3s2 3p6 4s2 3d2
e) 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6
Alternative correcte: d) 1s2 2s2 2p6 3s2 3p6 4s2 3d2.
Le diagramme de Linus Pauling pour la distribution des électrons dans le titane est :
question 2
(ACAFE) Considérant tout élément M générique, qui a 1s configuration électronique2 2s2 2p6 3s2 3p6 4s2 3d5, on peut dire que :
JE. son numéro atomique est 25 ;
II. a 7 électrons dans la dernière couche ;
III. a 5 électrons non appariés;
IV. appartiennent à la famille 7A.
Les déclarations sont correctes :
a) I, II et III uniquement
b) I et III uniquement
c) II et IV seulement
d) I et IV seulement
e) II, III et IV uniquement
Alternative correcte: b) I et III uniquement.
JE. CORRIGER En comptant le nombre d'électrons dans la distribution électronique, nous voyons que 25 ont été utilisés. Par conséquent, le numéro atomique est 25 et correspond à l'élément chimique manganèse.
II. TORT. La dernière couche, c'est-à-dire la couche la plus externe a 2 électrons, étant les 4s2.
III. CORRIGER Les électrons non appariés se trouvent dans le sous-niveau d, qui contient jusqu'à 10 électrons, mais dans la distribution électronique du manganèse, seuls 5 électrons ont été affectés au sous-niveau.
IV. TORT. Le manganèse se situe dans la famille 7B et dans la 4ème période.
question 3
(UFSC) Le nombre d'électrons dans chaque sous-niveau de l'atome de strontium (38Sr) dans l'ordre croissant d'énergie est :
a) 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2
b) 1s2 2s2 2p6 3s2 3p6 4s2 4p6 3d10 5s2
c) 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 5s2
d) 1s2 2s2 2p6 3s2 3p6 4p6 4s2 3d10 5s2
e) 1s2 2s2 2p6 3p6 3s2 4s2 4p6 3d10 5s2
Alternative correcte: a) 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2.
Le diagramme de Linus Pauling pour la distribution des électrons du strontium est :
Testez encore plus vos connaissances! Résolvez également :
- Exercices sur la distribution électronique
- Exercices sur le tableau périodique