Le pH représente le potentiel ionique de l'hydrogène et le pOH est le potentiel ionique hydroxy des solutions.
Ce sont des échelles logarithmiques utilisées pour mesurer le caractère acide et basique d'un échantillon.
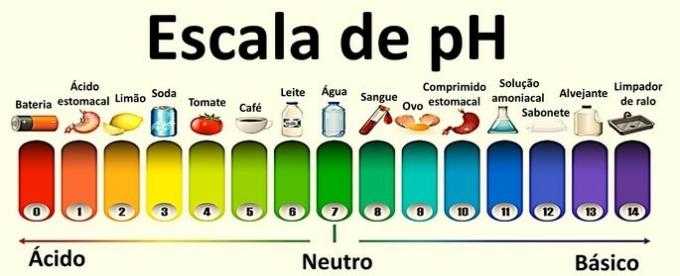
Les valeurs qui les composent vont de 0 à 14 et ont été obtenues à partir du bilan ionique de l'eau.
Une solution neutre a un pH de 7. Les valeurs inférieures à 7 classent les solutions comme acides, tandis qu'après 7 les solutions sont basiques.
Avec la valeur du pH, il est possible de trouver celle qui correspond sur l'échelle pOH, juste en faisant une soustraction.
Bilan hydrique ionique
Une molécule d'eau a la capacité de s'ioniser selon l'équation :
Ici, nous avons un équilibre ionique, car le processus est réversible et les ions peuvent également se réunir et former à nouveau une molécule d'eau.
Une autre façon de démontrer l'équilibre qui se produit est à travers le auto-ionisation.
Une molécule d'eau a généré des ions hydronium (H3O+) et hydroxyle (OH-) par la rupture d'une seconde molécule.
Produit ionique de l'eau (Kw)
La constante du bilan ionique de l'eau est :
L'eau étant un liquide pur, sa concentration est considérée comme 1 et n'interfère pas avec la valeur constante. L'expression devient donc :
O produit ionique de L'eau é .
Cette expression reçoit le symbole Kw (W vient du mot anglais water - l'eau) et comme la constante d'équilibre, elle varie avec la température.

Détermination du pH et du pOH
A une température de 25°C, le produit ionique de l'eau est :
Dans l'ionisation de l'eau pure, 1 mol de H3O+ est formé avec 1 mol de OH- .
Bientôt,
Ces valeurs étant extrêmement faibles, il a été décidé d'utiliser les valeurs des cologarithmes, qui correspondent au logarithme avec un signe interverti.
En appliquant le cologarithme au produit ionique de l'eau, il faut :
Nous pouvons observer que: si nous connaissons le pH d'une solution, la valeur de pOH peut être trouvée en soustrayant la première valeur de 14.
Acidité et basicité des solutions
Solution neutre: la concentration des ions hydronium est égale à celle des hydroxyles.
| [H3O+] = 1,0. 10-7 mol/L | pH = 7 |
| [Oh-] = 1,0. 10-7 mol/L | pOH = 7 |
Exemple: eau pure.
solution acide: la concentration des ions hydronium est supérieure à celle des hydroxyles.
| [H3O+] |
pH |
| [Oh-] |
pOH |
Exemple: soda, citron et tomate.
Solution basique: la concentration des hydroxyles est supérieure à celle des ions hydronium.
| [H3O+] |
pH |
| [Oh-] |
pOH |
Exemple: œuf, savon et eau de javel.
Calcul du pH
Le concept de potentiel hydrogéné a été créé par le chimiste danois Peter Lauritz Sorensen (1868-1939) pour exprimer l'acidité d'une solution par la concentration de H+.
Voir le tableau ci-dessous démontrant l'ionisation d'un acide:
| Molarité initiale | 0,020 | 0 | 0 |
| ionisation | 0,001 | 0,001 | 0,001 |
| Molarité en équilibre | 0,019 | 0,001 | 0,001 |
Dans l'exemple, nous avons que la concentration des ions H+ é 0,001. Le pH de la solution est donc :
[H+] = 0,001 = 10-3
pH = - log10-3 = 3
Le pH de la solution étant inférieur à 7, cette solution est acide.
Résumé sur le pH et le pOH
| Définitions | pH: potentiel ionique hydrogène de la solution. | |
|---|---|---|
| pOH: potentiel hydroxylionique de la solution. | ||
| formule générale | pH + pOH = 14 | |
| Solutions | Neutre | pH = pOH = 7 |
| acide |
pH pOH > 7 |
|
| bases |
pOH pH > 7 |
|
| Calcul du pH | pH = - log [H+] | |
| Calcul du pOH | pOH = -log[OH-] |
Exercices sur le pH et le pOH
1. (FMTM) Le pH du suc gastrique, une solution aqueuse d'acide chlorhydrique (HCℓ), est d'environ 2. Par conséquent, la masse, en grammes, de HCℓ existant dans chaque litre de suc gastrique, est
Données: Masses molaires (g/mol) H = 1, Cℓ = 35,5
a) 7,3 · 10-2
b) 3,65 · 10-1
c) 10-2
d) 2
e) 10
Alternative correcte: b) 3,65 · 10-1.
1ère étape: calculer la concentration en ions H+.
2ème étape: calculer la masse molaire de HCl.
3ème étape: calculer la masse d'acide chlorhydrique dans chaque litre de suc gastrique.
2. (UEMG) Plusieurs produits de nettoyage ont de l'ammoniac dans leur constitution. L'étiquette de l'un de ces produits indique pH = 11. Cela signifie que la concentration de cations hydroxons et d'anions hydroxyles dans ce produit est respectivement :
à 1. 10-3 et 1. 10-11
b) 1. 10-11 et 1. 10-7
c) 1. 10-11 et 1. 10-3
d) 1. 10-11 et 1. 10-11
Alternative correcte: c) 1. 10-11 et 1. 10-3.
Un tort. Ces concentrations correspondent à une solution de pH = 3.
b) FAUX. Bien que la concentration de H+ indiquent que le pH de la solution est de 11, la concentration en ions OH- est faux, comme il devrait être 3, puisque: pOH = 14 - pH.
c) CORRECT. pH = 11 et pOH = 3, puisque pH + pOH = 14.
d) FAUX. Bien que la concentration de H+ indiquent que le pH de la solution est de 11, la concentration en ions OH- est faux, comme il devrait être 3, puisque: pOH = 14 - pH.
a) 0,1 mol/L de NaOH
b) NaCl 0,5 mol/L
c) H2SEUL4 1,0 mol/L
d) 1,0 mol/L HCl
e) 0,2 mol/L de KOH
Alternative correcte: e) KOH 0,2 mol/L.
Un tort. La solution est basique car son pH est supérieur à 7, mais elle n'a pas le pH plus élevé des alternatives.
b) FAUX. NaCl est un sel car il est le produit d'une forte réaction acide-base. Son pH est donc neutre.
c) FAUX. L'acide sulfurique est un acide fort, son pH est donc faible.
d) FAUX. L'acide chlorhydrique est un acide fort, son pH est donc faible.
e) CORRECT. La solution est basique car son pH est supérieur à 7.