Le graphène est un nanomatériau composé uniquement de carbone, dans lequel les atomes se lient pour former des structures hexagonales.
C'est le cristal le plus fin connu et ses propriétés le rendent hautement désirable. Ce matériau est léger, conducteur d'électricité, rigide et étanche.
L'applicabilité du graphène est dans plusieurs domaines. Les plus connus sont: la construction civile, l'énergie, les télécommunications, la médecine et l'électronique.
Depuis sa découverte, le graphène est resté le centre d'intérêt de la recherche. L'étude des candidatures pour ce matériau mobilise des institutions et des investissements de plusieurs millions d'euros. Ainsi, les scientifiques du monde entier continuent d'essayer de développer un moyen moins coûteux de le produire à grande échelle.
Comprendre ce qu'est le graphène
Le graphène est une forme allotropique du carbone, où l'arrangement des atomes de cet élément forme une couche mince.
Cet allotrope est bidimensionnel, c'est-à-dire qu'il n'a que deux mesures: la largeur et la hauteur.
Pour se faire une idée de la taille de ce matériau, l'épaisseur d'une feuille de papier correspond à la superposition de 3 millions de couches de graphène.
Bien qu'il s'agisse du matériau le plus mince isolé et identifié par l'homme, sa dimension est de l'ordre du nanomètre. Il est léger et solide, capable de mieux conduire l'électricité que les métaux tels que le cuivre et le silicium.
L'arrangement que les atomes de carbone prennent dans la structure du graphène fait que des caractéristiques très intéressantes et souhaitables peuvent y être trouvées.
Applications de graphène
De nombreuses entreprises et groupes de recherche du monde entier publient les résultats de travaux impliquant des applications pour le graphène. Voir ci-dessous les principaux.
| Eau potable | Les membranes formées de graphène sont capables de dessaler et de purifier l'eau de mer. |
|---|---|
| Émissions de CO2 | Les filtres en graphène sont capables de réduire les émissions de CO2 en séparant les gaz générés par les industries et les entreprises qui seront rejetés. |
| détection des maladies | Des capteurs biomédicaux beaucoup plus rapides sont basés sur le graphène et peuvent détecter des maladies, des virus et d'autres toxines. |
| Construction | Les matériaux de construction tels que le béton et l'aluminium sont rendus plus légers et plus résistants grâce à l'ajout de graphène. |
| Beauté | Coloration des cheveux par pulvérisation de graphène, dont la durée serait d'environ 30 lavages. |
| Micro-dispositifs | Des puces encore plus petites et plus solides grâce au remplacement du silicium par du graphène. |
| Énergie | Les cellules solaires ont une meilleure flexibilité, plus de transparence et des coûts de production inférieurs avec l'utilisation du graphène. |
| Électronique | Les batteries avec un stockage d'énergie meilleur et plus rapide peuvent se recharger en 15 minutes maximum. |
| Mobilité | Les vélos peuvent avoir des pneus plus fermes et des cadres pesant 350 grammes utilisant du graphène. |
Structure du graphène
La structure du graphène est constituée d'un réseau de carbones liés en hexagones.
Le noyau de carbone est composé de 6 protons et 6 neutrons. Les 6 électrons de l'atome sont répartis en deux couches.
À couche de valence il y a 4 électrons, avec cette coquille pouvant contenir jusqu'à 8. Par conséquent, pour que le carbone acquière de la stabilité, il doit effectuer 4 connexions et atteindre la configuration électronique d'un gaz rare, comme indiqué dans la règle de l'octet.
Les atomes du graphène se lient par des liaisons covalentes, c'est-à-dire qu'il y a le partage des électrons.

Les liaisons carbone-carbone sont les liaisons les plus fortes trouvées dans la nature et chaque carbone rejoint les 3 autres dans la structure. Par conséquent, l'hybridation de l'atome est sp2, ce qui correspond à 2 liaisons simples et une double liaison.
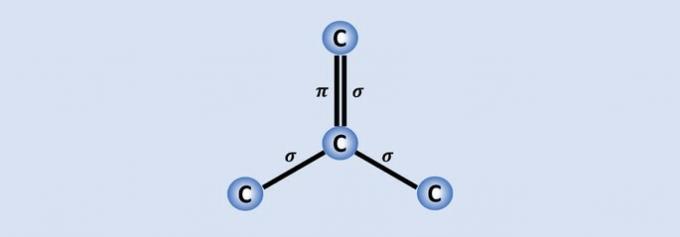
Sur les 4 électrons de carbone, trois sont partagés avec les atomes voisins et un, qui constitue la liaison. , aide le graphène, par exemple, à être un bon conducteur d'électricité car il a plus de "liberté" dans le matériau.
Propriétés du graphène

| Lumière | Un mètre carré ne pèse que 0,77 milligramme. Un aérogel de graphène est environ 12 fois plus léger que l'air. |
|---|---|
| Souple | Il peut s'étendre jusqu'à 25 % de sa longueur. |
| Conducteur | Sa densité de courant supérieure à celle du cuivre. |
| Durable | Il se dilate à froid et se rétracte à chaud. La plupart des substances agissent en sens inverse. |
| Étanche | Le maillage formé par les carbones ne permet même pas le passage d'un atome d'hélium. |
| Résistant | Environ 200 fois plus résistant que l'acier. |
| Translucide | Absorbe seulement 2,3% de lumière. |
| Mince | Un million de fois plus fin qu'un cheveu humain. Son épaisseur n'est que d'un atome. |
| Difficile | Matériau le plus dur connu, encore plus que le diamant. |
Histoire et découverte du graphène
Le terme graphène a été utilisé pour la première fois en 1987, mais n'a été officiellement reconnu qu'en 1994 par l'União de Química Pure and Applied.
Cette appellation est née de la jonction de graphite avec le suffixe -ene, se référant à la double liaison de la substance.
Depuis les années 1950, Linus Pauling parlait dans ses cours de l'existence d'une fine couche de carbone, constituée d'anneaux hexagonaux. Philip Russell Wallace a également décrit certaines propriétés importantes de cette structure des années plus tôt.
Cependant, ce n'est que récemment, en 2004, le graphène a été isolé par les physiciens Andre Geim et Konstantin Novoselov à l'Université de Manchester et peut être profondément connu.
Ils étudiaient le graphite et en utilisant la technique de l'exfoliation mécanique ils ont réussi à isoler une couche de matériau à l'aide de ruban adhésif. Cet exploit a décerné le prix Nobel au couple en 2010.
Importance du graphène pour le Brésil
Le Brésil possède l'une des plus grandes réserves de graphite naturel, un matériau qui contient du graphène. Les réserves naturelles de graphite atteignent 45% du total mondial.
Bien que la présence de graphite soit observée sur tout le territoire brésilien, les réserves exploitées se trouvent dans le Minas Gerais, Ceará et Bahia.
Avec une matière première abondante, le Brésil investit également dans la recherche dans le domaine. Le premier laboratoire d'Amérique latine dédié à la recherche avec le graphène est situé au Brésil, à l'Universidade Presbiteriana Mackenzie à São Paulo, appelé MackGraphe.
Fabrication de graphène
Le graphène peut être préparé à partir de carbure, d'hydrocarbure, de nanotube de carbone et de graphite. Ce dernier étant le plus utilisé comme matière première.
Les principales méthodes de production de graphène sont :
- Microexfoliation mécanique: Un cristal de graphite a des couches de graphène enlevées à l'aide d'un ruban, qui sont déposées sur des substrats contenant de l'oxyde de silicium.
- Microexfoliation chimique: les liaisons carbone sont affaiblies par l'ajout de réactifs, brisant partiellement le réseau.
- dépôt chimique en phase vapeur: formation de couches de graphène déposées sur des supports solides, tels que la surface de nickel métallique.
Prix du graphène
La difficulté de synthétiser le graphène à l'échelle industrielle fait que la valeur de ce matériau est encore très élevée.
Comparé au graphite, son prix est des milliers de fois plus élevé. Alors que 1 kg de graphite est vendu à 1 dollar, la vente de 150 g de graphène se fait à 15 000 dollars.
Curiosités sur le graphène
- projet de l'Union européenne, nommé Graphène Flagship, a affecté environ 1,3 milliard d'euros à la recherche liée au graphène, aux applications et au développement de la production à l'échelle industrielle. Environ 150 institutions dans 23 pays participent à ce projet.
- La première valise développée pour les voyages dans l'espace a du graphène dans sa composition. Son lancement est prévu pour 2033, date à laquelle la NASA prévoit de mener des expéditions vers Mars.
- Le borophène est le nouveau concurrent du graphène. Ce matériau a été découvert en 2015 et est considéré comme une version améliorée du graphène, étant encore plus flexible, résistant et conducteur.
Graphène dans Enem
Dans le test Enem 2018, l'une des questions de Sciences naturelles et ses technologies concernait le graphène. Consultez ci-dessous la résolution commentée de ce problème.
Le graphène est une forme allotropique de carbone constituée d'une feuille plane (réseau bidimensionnel) d'atomes de carbone compactés qui n'ont qu'un atome d'épaisseur. Sa structure est hexagonale, comme le montre la figure.
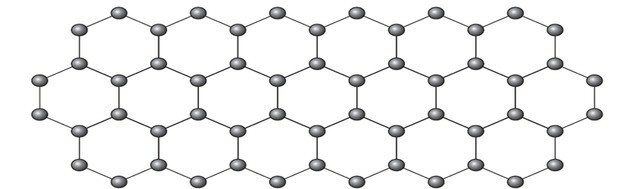
Dans cet arrangement, les atomes de carbone ont une hybridation
a) sp de géométrie linéaire.
b) sp2 de la géométrie trigonale plane.
c) sp3 alterné avec des carbones hybrides sp de géométrie linéaire.
d) sp3d de géométrie plane.
e) sp3ré2 à géométrie plane hexagonale.
alternative correcte:b) sp2 de la géométrie trigonale plane.
L'allotropie du carbone se produit en raison de sa capacité à former différentes substances simples.
Parce qu'il a 4 électrons dans la couche de valence, le carbone est tétravalent, c'est-à-dire qu'il a tendance à faire 4 liaisons covalentes. Ces liaisons peuvent être simples, doubles ou triples.
Selon les liaisons que le carbone fait, la structure spatiale de la molécule change pour l'arrangement qui s'adapte le mieux aux atomes.
L'hybridation se produit lorsqu'il y a une combinaison d'orbitales, et pour le carbone cela peut être: sp, sp2 et sp3, selon le type d'appels.
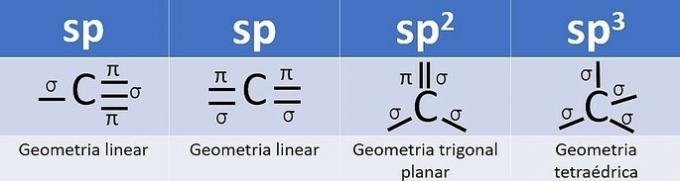
Le nombre d'orbitales hybrides est la somme des liaisons sigma (σ) que le carbone fait, car la liaison ne s'hybride pas.
- sp: 2 liens sigma
- sp2: 3 liens sigma
- sp3: 4 liens sigma
La représentation de l'allotrope du graphène en boules et en bâtonnets, comme le montre la figure de la question, ne démontre pas les véritables liaisons de la substance.
Mais si nous regardons une partie de l'image, nous voyons qu'il y a un carbone, représentant une boule, se connectant à trois autres carbones formant une structure comme un triangle.
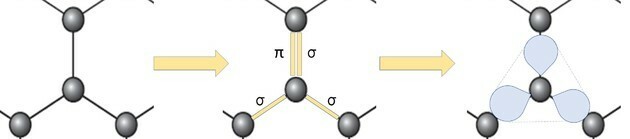
Si le carbone a besoin de 4 liaisons et est lié à 3 autres carbones, alors l'une de ces liaisons est double.
Parce qu'il a une double et deux simples liaisons, le graphène a une hybridation sp2 et, par conséquent, la géométrie plane trigonale.
Les autres formes allotropiques connues du carbone sont: le graphite, le diamant, le fullerène et le nanotube. Bien qu'ils soient tous constitués de carbone, les allotropes ont des propriétés différentes, résultant de leurs différentes structures.
Lire aussi: Chimie à Enem et Questions de chimie à Enem.