Le chlore est un élément chimique de symbole Cl, de numéro atomique 17, de masse atomique 35,5. Il appartient à la famille des halogènes, groupe 17 ou 7A, et à la troisième période du tableau périodique.
Son nom vient du grec khloros, ce qui signifie verdâtre. En effet, dans des conditions normales de température et de pression, le chlore se caractérise par être un gaz jaune verdâtre avec une forte odeur.
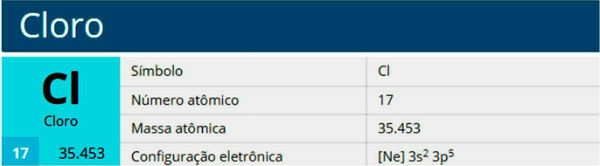
Caractéristiques
Le chlore a été découvert en 1774 par le scientifique suédois Carl Wilhelm Scheele (1742-1786). Cependant, à cette époque, je croyais que c'était un composé avec de l'oxygène. En 1810, Humphry Davy (1778-1829) démontra qu'il s'agissait d'un nouvel élément chimique.
Comme il s'agit d'un élément extrêmement réactif, il est peu présent dans la nature sous sa forme pure, à l'exception de la faible quantité émise lors des éruptions volcaniques sous forme de HCl.
Ainsi, on le trouve couramment sous forme de chlorure de sodium (NaCl), également connu sous le nom de sel de table. Dans les minéraux, il se présente sous forme de carnallite et de sylvite.
Il peut également être obtenu par électrolyse de NaCl, en solution aqueuse. Le chlore produit également de nombreux sels à partir des chlorures par le processus de oxydation.
En savoir plus, lire aussi :
- Tableau périodique
- Éléments chimiques
- Halogènes
applications
Chlore gazeux (Cl2) est toxique et irritant, cette condition a conduit à son utilisation comme arme chimique pendant la 1ère guerre mondiale. Ce gaz provoque une irritation des voies respiratoires et de la peau, une rétention d'eau dans les poumons, des larmoiements et, lorsqu'il est inhalé en grande quantité, peut entraîner la mort.
Certaines autres utilisations du chlore sont :
- Blanchiment du papier et des tissus au dioxyde de chlore (ClO2).
- Traitement de l'eau, l'ajout de chlore rend l'eau potable et propre à la consommation humaine. Ce processus est appelé chloration et utilise de l'acide hypochloreux (HClO).
- Désinfection de l'eau de piscine et des déchets industriels, car le chlore est capable de tuer les micro-organismes.
- Production de composés plastiques tels que le PVC (chlorure de polyvinyle) et le caoutchouc synthétique.
- Production de certains types de composés organiques et inorganiques.



