LES énergie d'activation c'est la quantité minimale d'énergie nécessaire pour que la collision entre les particules de réactif, effectuée dans une orientation favorable, ait lieu et aboutisse à une réaction.
Les réactions ne se produisent que lorsque les réactifs ont une énergie d'activation (ou l'énergie minimale nécessaire, qui varie d'une réaction à l'autre; en quantité ou en forme) ou lorsqu'il leur est fourni.
Par exemple, lorsque le sodium métallique entre en contact avec de l'eau, il réagit violemment. Cela signifie que le contenu énergétique de ces réactifs est déjà suffisant pour que la réaction ait lieu.
Dans le cas d'allumer un poêle, la réaction de combustion ne se produira que si nous plaçons une allumette allumée ou une autre source de feu à proximité du gaz qui est libéré par le poêle. Cela signifie que, dans ce cas, il était nécessaire de fournir de l'énergie au système pour qu'il atteigne l'énergie d'activation et que la réaction ait lieu.
Dans le cas du luminophore lui-même utilisé, pour qu'il brûle, l'énergie d'activation est fournie par frottement. Il en va de même pour les briquets, qui ont également besoin d'une étincelle qui donne l'énergie d'activation nécessaire à la combustion du gaz qu'ils contiennent.
L'énergie d'activation peut également être fournie par la lumière, comme c'est le cas avec la décomposition du peroxyde d'hydrogène. C'est pourquoi il est stocké dans des bouteilles sombres ou opaques.
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)

Ainsi, nous pouvons conclure que l'énergie d'activation (Ejusqu'à ce que) est la différence entre l'énergie nécessaire au démarrage de la réaction (E) et l'énergie contenue dans les réactifs (Epr):

L'énergie d'activation est un obstacle pour que la réaction ait lieu et elle est nécessaire pour rompre les liaisons des réactifs. Avec cela, la réaction a lieu et de nouvelles connexions sont établies pour former les produits.
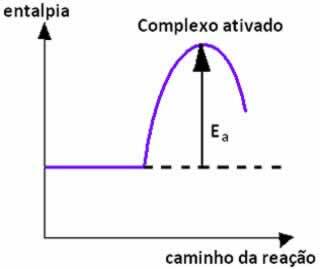
Lorsque la collision entre des particules de réactifs d'orientation favorable se produit avec une énergie égale ou supérieure à l'énergie d'activation, avant la formation des produits, un état intermédiaire et instable se forme, dénommé complexe activé, dans lequel les liaisons réactives sont affaiblies et les liaisons produits se forment. Ainsi, l'énergie d'activation est l'énergie nécessaire pour former le complexe activé.
Ci-dessous, nous avons un graphique qui montre l'énergie d'activation comme une barrière pour que la réaction ait lieu :
Par Jennifer Fogaça
Diplômé en Chimie
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
FOGAÇA, Jennifer Rocha Vargas. « Énergie d'activation »; École du Brésil. Disponible en: https://brasilescola.uol.com.br/quimica/energia-ativacao.htm. Consulté le 27 juin 2021.


