Le gallium est un élément chimique de numéro atomique (Z) égal à 31 et de symbole Ga. Il appartient à la famille 13 (ou groupe IIIA, selon l'ancienne numérotation), qui est la famille des bore, étant un métal de couleur "argenté" similaire à l'aluminium.
L'une de ses propriétés les plus intéressantes est son point de fusion, qui est bas comparé à presque tous les métaux (sauf le mercure) connus auparavant, environ 29,76°C. Ainsi, dans les conditions ambiantes, il est généralement à l'état solide. Cependant, les jours les plus chauds, il fond à l'état liquide. C'est pourquoi, si nous tenons ce métal dans nos mains, il commencera à fondre, car notre température est supérieure à son point de fusion.

Lors du stockage du gallium, il ne peut pas remplir tout le récipient car il se dilate en se solidifiant
Il existe de nombreuses vidéos sur Internet qui montrent une cuillère qui fond lorsqu'elle est placée dans un verre d'eau. En fait, ces cuillères sont faites de gallium, pas d'autres métaux ou alliages métalliques plus courants tels que l'aluminium ou
acier. Ainsi, lorsque la cuillère de gallium est placée dans de l'eau tiède, elle devient liquide. Voir plus à ce sujet dans le texte "Proposition d'une classe expérimentale sur le point de fusion”.Le gallium a également une autre caractéristique différente, qui est la vaste plage entre les températures de fusion et d'ébullition. Comme déjà mentionné, son point de fusion est d'environ 29,76°C, mais son point d'ébullition est d'environ 2204°C.
Le gallium a été découvert entre 3 heures du matin et 4 heures du matin le 27 août 1875 par le chimiste français Paul Lecoq de Boisbaudran. Un aspect intéressant est que des années plus tôt, en 1868, le chimiste russe Dimitri Ivanovitch Mendeleyev (1834-1907) a proposé le tableau périodique, mais a laissé un vide pour un élément qui jusque-là était inconnu. Mendeleïev l'a appelé eka-aluminium, car il a prédit de manière spectaculaire que dans la rangée horizontale de bore, entre l'aluminium et l'uranium, cet élément se trouverait.

Le chimiste français Paul Lecoq de Boisbaudran – découvreur du gallium
Mendeleïev a même prédit les propriétés de cet élément, telles que son poids atomique, qui serait de 68, et sa densité, qui serait de 5,9. Ainsi, Lecoq a découvert un élément avec un poids atomique de 69 et une densité de 4,7, indiquant que Mendeleïev avait tort. Cependant, Mendeleïev a déclaré que l'échantillon de Lecoq n'était pas assez pur et qu'il devrait répéter les expériences.
C'est ce que Lecoq a fait, et étonnamment Mendeleïev avait raison, la gravité spécifique de ce nouvel élément était de 5,9. C'était donc bien l'eka-aluminium que Mendeleïev avait imaginé.
Lecoq a donné le nom « Gallium » à l'élément découvert en référence au nom latin de la France, qui est Gallia. Mais il y en a qui disent qu'en fait, leur but était un autre, car en français, Le coq signifie « le coq » et en latin c'est galle.
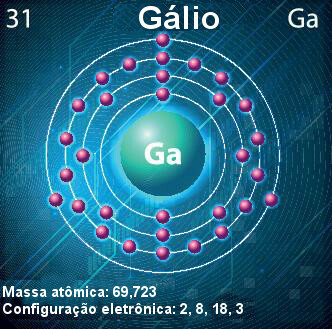
Atome de gallium — symbole, numéro atomique, masse atomique et configuration électronique
Une autre propriété du gallium est qu'il corrode d'autres métaux. Sur Internet, il existe des vidéos qui montrent le placement d'un peu de gallium liquide sur une canette en aluminium. Au bout de quelques heures, il est possible de le casser avec les mains très facilement.
Parmi les applications du gallium, on peut souligner :
* Il est utilisé dans la fabrication de miroirs ;
* C'est un semi-conducteur et conduit la chaleur deux fois plus que le le fer. Par conséquent, il est utilisé dans la production de diodes, LED, transistors et capteurs de température, de lumière et de champ magnétique ;
* Dans les thermomètres utilisés pour des températures très élevées ;
* Dans la fabrication de les alliages de métaux qui doivent avoir des points de fusion bas;
* Obtention d'hydrogène gazeux par contact entre l'alliage d'aluminium et de gallium et l'eau ;
* L'isotope Ga-37 est radioactif et est utilisé comme traceur dans les tests pour détecter les maladies et les tumeurs.
Par Jennifer Fogaça
Diplômé en Chimie