O nitrate d'ammonium est une substance solide de formule moléculaire NH4AU3 et aspect blanc (quand pur). constitué par le ions NH4+ (ammonium) et NO3- (nitrate), n'est pas inflammable, mais est hautement oxydant et réactif. Sa réaction de décomposition génère un grand volume de gaz en tant que produit, ce qui rend le stockage inapproprié de ce produit un problème sérieux, car des explosions peuvent se produire. Et aussi largement utilisé en agriculture comme engrais.
A lire aussi: Substances naturelles - molécules issues de la nature
Qu'est-ce que le nitrate d'ammonium ?

Nitrate d'ammonium c'est un sel constitué d'ions NH4+ (ammonium) et NO3- (nitrate). C'est un composé solide qui, à l'état pur, il est de couleur blanche. Il est largement utilisé comme engrais agricole, mais il peut également être utilisé dans la fabrication d'explosifs, comme c'est une substance très oxydante, puis oxydant. La réaction d'emballement du nitrate d'ammonium génère une forte libération de des gaz, provoquant impact explosif.
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
Caractéristiques du nitrate d'ammonium
Masse molaire: 80,04336 g/mol.
Sel composé des ions: ammonium (NH4+) et nitrate (NO3-).
Aspect: solide blanc.
C'est un fort oxydant.
Réagit facilement avec d'autres substances.
Il n'est pas inflammable.
Pour des conditions normales de température et de pression :
- densité: 1,73 g/cm³ ;
- point d'ébullition: 210 °C ;
- point de fusion: 169,6 °C ;
- degré de solubilité dans l'eau: 216 g/100 ml ;
- pH: 5,5 (0,2M).
Formule de nitrate d'ammonium
La formule moléculaire de ce composé est NH4AU3.

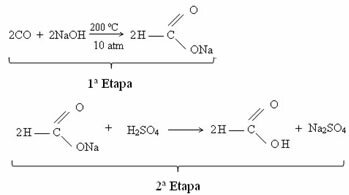
Décomposition du nitrate d'ammonium
pour être un substance à haute réactivité et à haut potentiel oxydant, le nitrate d'ammonium, lorsqu'il est soumis à une température élevée, déclenche une réaction de décomposition, et les principaux produits sont les gaz, l'azote, oxygène et la vapeur d'eau. La décomposition est donnée en deux étapes :
→ 1ère étape :
2NH4AU3 (s) → 2N2O(g) + 4H2O(g)
→ 2ème étape :
2N2O → 2N2(g) + O2(g)
→ Équation globale:
2NH4AU3 (s) → 2N2(g) + O2(g) + 4H2O(g)
Notez que, dans la première équation,l'un des produits obtenu dans la décomposition est le protoxyde d'azote (N2O), aussi connu sous le nom gaz hilarant. Il est utilisé pour augmenter la puissance des moteurs automobiles pour brûler du carburant et comme anesthésique, principalement par les dentistes. C'est aussi l'un des principaux gaz responsables de Effet de serre.
Voir aussi: Quels sont les types de réactions chimiques ?
Production de nitrate d'ammonium
Le nitrate d'ammonium peut être obtenu par réaction entre sulfate d'ammonium (NH4)2SEUL4 et le nitrate de calcium Ca (NO3)2. Voir ci-dessous:
(NH4)2SEUL4 + Ca (NON3)2 → 2 NH4AU3+ Étui4
Il peut également être produit à partir d'ammoniac gazeux, que l'on fait barboter dans une solution d'acide nitrique, ayant comme produit de réaction le nitrate d'ammonium aqueux. Voir:
NH3(g) + HNO3(aq) → NH4AU3(ici)
Utilisations du nitrate d'ammonium

- Fabrication d'engrais
- Explosifs dans les mines, les carrières et la construction
- Herbicides et insecticides
- Obtention de protoxyde d'azote pour application industrielle
- Absorbants pour oxydes
- Oxydant pour propergols de fusée
- Fabrication de sacs isothermes
- Production de fumée anesthésiante pour la gestion des ruches en apiculture
Accédez également à: Comment combattre un incendie ?
Dangers liés au nitrate d'ammonium
L'un des principaux risques associés au nitrate d'ammonium est stockage inadéquat. Comme c'est une substance très oxydante et qu'elle réagit avec plusieurs autres composés, elle déclenche une réaction avec dégagement d'un grand volume de gaz. Un stockage inapproprié est sujet à la contamination par des produits inflammables, à l'exposition à la chaleur ou à la rétention de gaz, ce qui peut provoquer des explosions.
Cela s'est déjà produit au Texas, aux États-Unis par exemple, avec un cargo venu de France transportant 2 086 tonnes de nitrate d'ammonium. l'accident est arrivé en 1947 et est devenu connu comme la catastrophe de Texas City. La tragédie a causé la mort de 581 personnes et il s'est produit en raison d'un incendie non contenu dans le navire qui a atteint la cargaison d'ammonium, déclenchant l'explosion.
Un autre exemple était le séquence d'explosion qui s'est passé le 4 août 2020 au port de ville de Beyrouth, Liban, faisant plus de 100 morts et 5 000 blessés. L'ampleur de l'explosion a été provoquée par l'inflammation d'une réaction en chaîne de la cargaison de 2 750 tonnes de nitrate d'ammonium qui y était stockée.
Il convient également de noter que le nitrate d'ammonium peut causer irritation de la peau et des yeux et, en cas d'inhalation, problèmes de respiration. Dans la circulation sanguine, la substance a un pouvoir toxique, car elle réagit avec les fluides corporels, et les produits de cette réaction, tels que les nitrates, peuvent nuire à la santé, tels que maladie du bébé bleu, également connu sous le nom de méthémoglobinémie infantile (faible taux d'hémoglobine dans le sang). Cette maladie est récurrente dans les familles en milieu rural en raison de la contamination par le nitrate d'ammonium, présent dans les engrais, des plans d'eau de la région agricole.
par Laysa Bernardes
Professeur de chimie
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
ARAúJO, Laysa Bernardes Marques de. "Nitrate d'ammonium"; École du Brésil. Disponible en: https://brasilescola.uol.com.br/quimica/nitrato-de-amonio.htm. Consulté le 27 juin 2021.
La biologie
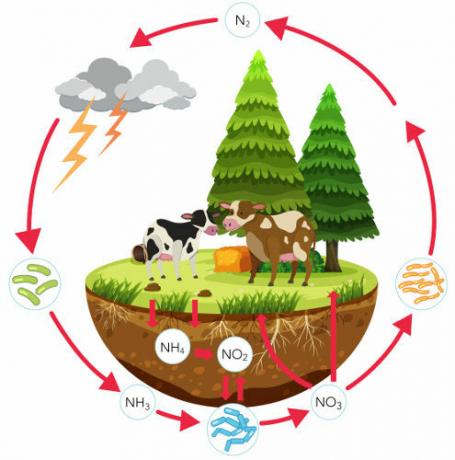
Apprenez-en plus sur le cycle de l'azote, un cycle biogéochimique important qui assure la circulation de cet élément. Dans ce texte, nous aborderons chaque étape du cycle de l'azote, discuterons de son importance et nous concentrerons sur le rôle des bactéries dans ce processus. Nous présenterons également des exercices sur le sujet.