La glace sèche est appelée ainsi car malgré son apparence de glace (eau à l'état solide), il s'agit en fait de dioxyde de carbone solide (dioxyde de carbone - CO2). Et, contrairement à la glace ordinaire qui fond, elle passe directement à l'état gazeux, c'est-à-dire qu'elle se sublime.
C'est la propriété la plus importante de la glace sèche, car lorsqu'elle passe à l'état gazeux, elle entraîne des molécules d'eau avec elle, créant un brouillard plus dense que l'air. grâce à cela "Fumée blanche" formé, la glace sèche il est largement utilisé comme ressource scénique dans les films, les concerts, les théâtres, les émissions de télévision et les fêtes.
Mais, la question se pose: en quoi la glace sèche est-elle différente des autres substances impliquées dans sa sublimation? Que se passe-t-il entre vos molécules ?
Le dioxyde de carbone n'est pas polaire, donc lorsqu'il est à l'état solide, comme la glace sèche, son les molécules restent dans les cristaux moléculaires grâce à une force d'attraction intermoléculaire entre elles, qui est le
dipôle induit. Cette force apparaît lorsque vos molécules se rapprochent et qu'il y a une répulsion entre vos électrons, entraînant des déformations momentanées dans vos nuages électroniques. Cela signifie que des dipôles momentanés apparaissent dans les molécules, qui induisent des molécules adjacentes, entraînant des forces d'attraction.Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
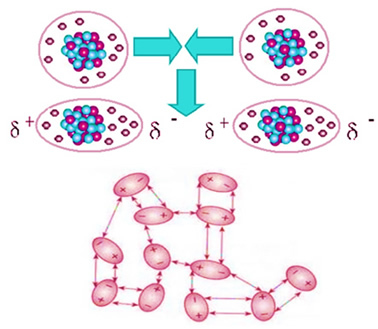
C'est la seule force intermoléculaire présente dans les molécules non polaires de la glace sèche et son intensité est très faible. La force dipolaire induite est la plus faible de toutes. Ainsi, il faut peu d'énergie pour briser ces forces d'attraction et faire changer le composé d'état physique. C'est pourquoi la glace carbonique se sublime à -78,6°C, sous une pression de 1 atm.
D'autres exemples de substances qui ont également ce type d'interaction intermoléculaire et qui se subliment également sont boules de naphtaline C'est le iode solide.

Par Jennifer Fogaça
Diplômé en Chimie
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
FOGAÇA, Jennifer Rocha Vargas. "Pourquoi la glace carbonique sublime-t-elle ?"; École du Brésil. Disponible en: https://brasilescola.uol.com.br/quimica/por-que-gelo-seco-sublima.htm. Consulté le 28 juin 2021.
Chimie

Dioxyde de carbone solide, glace carbonique, utilisé comme effet spécial dans les films d'horreur et les concerts de rock, dioxyde de carbone gazeux. carbone, sublimation, nuage blanc dense, excellente option pour la réfrigération, dioxyde de carbone liquide, extincteur dioxyde



