O acide formique tire son nom parce que sa première obtention était par distillation de fourmis rouges (du latin formica = fourmi), qui injectent cet acide carboxylique par leur piqûre, provoquant une douleur intense, un gonflement et des démangeaisons.
Cependant, sa nomenclature officielle est l'acide méthaneique, dont la formule structurelle est représentée ci-dessous :

En plus des fourmis, l'acide méthanoïque se trouve également dans les abeilles, les orties, les pins et certains fruits.
À température ambiante, il est incolore, liquide, caustique, à forte odeur et irritant. Cet acide est utilisé comme mordant, dans la production de monoxyde de carbone, dans le traitement contre les rhumatismes, dans la production d'acide oxalique, comme germicide, comme désinfectant et dans la production d'autres produits Biologique.
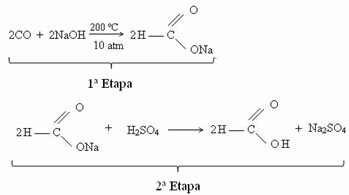
Actuellement, l'acide formique est obtenu par réaction entre le monoxyde de carbone et la soude caustique. Cette réaction est une technique similaire à celle mise au point en 1855 par le chimiste français Marcellin Berthelot (1827-1907). Ensuite, nous avons cette réaction, dans laquelle on obtient d'abord du méthanoate de sodium, qui, après avoir réagi avec de l'acide sulfurique, produit de l'acide méthaneique comme l'un des produits :
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
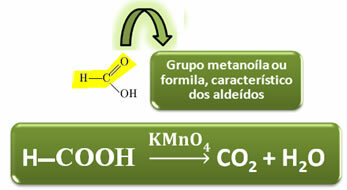
Contrairement aux autres acides carboxyliques, l'acide formique possède le groupement fonctionnel des aldéhydes, ce qui lui confère la propriété d'agir comme réducteur. Réduit les réactifs Fehling et Tollens, étant oxydés en dioxyde de carbone et en eau.
Par Jennifer Fogaça
Diplômé en Chimie
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
FOGAÇA, Jennifer Rocha Vargas. "Acide formique"; École du Brésil. Disponible en: https://brasilescola.uol.com.br/quimica/Acido-formico.htm. Consulté le 28 juin 2021.


