Une solution est un mélange homogène de deux substances ou plus.. Comme, par exemple, une solution de sel (soluté) dissous dans l'eau (solvant).

Surtout dans les laboratoires chimiques et les industries, ce processus est très important, car le chimiste doit préparer des solutions avec des concentrations connues. De plus, dans les activités expérimentales, des solutions à très faibles concentrations sont utilisées, de sorte qu'un échantillon de la solution concentrée est dilué à la concentration souhaitée.
Au quotidien, plusieurs fois, sans même nous en rendre compte, nous effectuons le processus de dilution des solutions. Par exemple, l'emballage des produits de nettoyage et d'hygiène ménagère, comme les désinfectants, conseille de les diluer avant utilisation. Certains fabricants suggèrent sur les étiquettes des produits qu'il soit dilué avec de l'eau dans une proportion de 1 à 3, c'est-à-dire que pour chaque partie du produit, 3 parties d'eau doivent être ajoutées. Ceci est dû au fait que le produit est très concentré et fort et peut endommager l'endroit où il sera appliqué s'il n'est pas dilué de la bonne manière. En revanche, si vous le diluez plus qu'il ne le devrait, vous pouvez perdre de l'argent, car le produit n'atteindra pas le résultat souhaité.

Un autre exemple est lorsque nous faisons des jus. Les étiquettes de nombreux jus concentrés indiquent qu'un verre de jus doit être dilué ou mélangé avec 5 verres d'eau. Ainsi, le jus devient « plus faible », c'est-à-dire moins concentré.
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
Imaginez que vous ayez dilué un tel jus dans 3 L d'eau. Si la concentration initiale du jus était de 40g/L, cela signifie qu'il avait une masse de 40g pour chaque litre de solvant. Mais comme on aura 3 L, la masse sera divisée par 3 et la concentration sera alors d'environ 13, 33 g/L, soit 13 grammes pour chaque litre de solution. Cependant, dans toute la solution, la masse du soluté de 40 g reste toujours.
Le calcul de cette nouvelle concentration peut se faire comme suit :
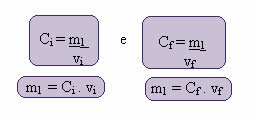
Où les indices i et f représentent respectivement les valeurs initiale et finale. Puisque la valeur de m1 n'a pas changé, nous pouvons égaliser les équations :
Çje. vje = CF. vF
En remplaçant les valeurs que nous avons, selon l'exemple précédent, notez :
Résolution initiale :
Çje: 40g/L
m1: 40g
vje: 1L
Solution finale:
ÇF: ?
m1: 40g
vF: 3L
Çje. vje = CF. vF
(40g/L). (1 L) = CF. 3L
ÇF = 40g/L
3
ÇF = 13,333 g/L
Le même raisonnement est également valable pour la concentration molaire (M) et pour le pourcentage massique de soluté ou titre (T) :
Mje. vje = MF. vF et Tje. vje = TF. vF
Par Jennifer Fogaça
Diplômé en Chimie
Équipe scolaire du Brésil
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
FOGAÇA, Jennifer Rocha Vargas. « Dilution des solutions »; École du Brésil. Disponible en: https://brasilescola.uol.com.br/quimica/diluicao-solucoes.htm. Consulté le 27 juin 2021.