À molécules ce sont des structures qui ont une masse molaire déterminée et un nombre relativement petit et exact d'atomes liés entre eux de manière covalente, c'est-à-dire par le partage d'électrons.
Voir trois exemples :
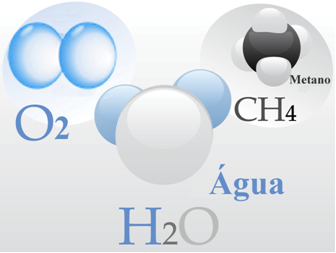
- Oxygène gazeux: Ses molécules sont formées chacune par une double liaison, c'est-à-dire par le partage de deux paires d'électrons entre deux atomes d'oxygène (O2);
- L'eau: elle est formée de molécules H2O. Ce qui signifie que chaque molécule a deux atomes d'hydrogène partageant une paire d'électrons chacun avec un atome d'oxygène.
- Méthane: ce composé est formé de molécules CH4, dans laquelle quatre atomes d'hydrogène se lient de manière covalente à un atome de carbone.
Les substances moléculaires ont des propriétés caractéristiques, telles que :
- Solubilité variée dans l'eau et d'autres solvants ;
- Ils peuvent se présenter dans les trois états physiques ;
- En général, ce sont des isolants électriques, à la fois solides et liquides.
Toutes les molécules sont formées d'éléments non métalliques, c'est-à-dire qu'elles ne contiennent que de l'hydrogène, des non-métaux et des semi-métaux. Mais ces éléments peuvent aussi former des substances qui ne sont présentes qu'à l'état solide et qui ont des propriétés très différentes de celles des molécules. Voici les
macromolécules.Les macromolécules, également appelées solides covalents ou alors solides de réseau covalent,ce sont des structures avec une masse molaire très élevée et imprécise, en plus d'être formées par une quantité importante et indéterminée d'atomes qui se lient de manière covalente pour former des réseaux tridimensionnels. Les macromolécules forment le cristaux covalents ou alors cristaux atomiques.
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
Par exemple, les atomes de carbone peuvent partager des électrons de plusieurs manières et former de nombreuses substances simples différentes. Cette propriété qu'un même élément chimique doit former deux ou plusieurs substances simples différentes porte le nom de allotropie.
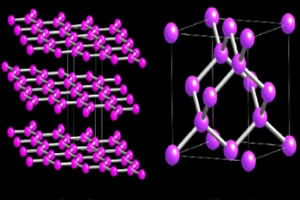
Deux variétés allotropiques de carbone qui forment des macromolécules sont les diamant et le graphite. Dans les images ci-dessous, vous pouvez voir que, dans le cas du diamant, chaque atome de carbone se lie à quatre autres atomes de carbone et donne naissance à une macromolécule de structure tétraédrique.

Parallèlement, la structure en graphite est formée d'anneaux hexagonaux contenus dans un même plan. Les atomes de carbone forment une liaison double et deux liaisons simples.

Mais les macromolécules ne sont pas simplement constituées d'un seul type d'élément; ils peuvent également être formés d'atomes de différents éléments chimiques.
Un exemple est le dioxyde de silicium (quartz), dont les macromolécules ont chaque atome de silicium entouré de quatre atomes de carbone et chaque atome d'oxygène lié à deux atomes de silicium.
Par Jennifer Fogaça
Diplômé en Chimie
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
FOGAÇA, Jennifer Rocha Vargas. « Molécules et macromolécules »; École du Brésil. Disponible en: https://brasilescola.uol.com.br/quimica/moleculas-macromoleculas.htm. Consulté le 28 juin 2021.
Chimie
Qu'est-ce que l'allotropie, les substances simples, l'oxygène gazeux, l'ozone, les formes allotropiques, l'oxygène des éléments chimiques, les rayons ultraviolets du soleil, le diamant, le graphite, l'atomicité, le phosphore blanc.
Formule spatiale du carbone, formule électronique de Lewis, structure plane, paires électroniques, liaison covalent, couche de valence, évolution du modèle atomique, formule moléculaire, formule développée, formules tridimensionnel.
Formules chimiques, formule structurelle plate, formule structurelle Couper, triple liaison, gaz azote, formule électronique, formule de Lewis, formule moléculaire, liaison simple, double liaison, gaz carbonique.



