Il peut arriver qu'il y ait des acides du même élément, et que cet élément ait le même indice d'oxydation (NOX), mais la différence réside dans les degrés d'hydratation.
Par exemple, ci-dessous, nous avons trois acides formés par l'élément phosphore (P) :
H3POUSSIÈRE4 H4P2O7 HPO3
Notez que dans les trois acides, le nombre d'oxydation du phosphore est de +5; la différence réside dans le degré d'hydratation.
Sur cette base, ces acides sont différenciés dans la nomenclature par les préfixes ortho, pyro et méta.
L'acide le plus hydraté est appelé ortho. Dans l'exemple donné, le premier (H3POUSSIÈRE4) est appelé acide orthophosphorique, car c'est la plus hydratée des trois. Le préfixe ortho est consommable, donc la plupart du temps cet acide sera simplement appelé acide phosphorique.
Les préfixes pyro et meta sont utilisés avec l'acide ortho comme point de référence :
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
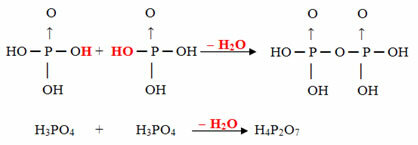
- Pyrus: 2 molécules d'ortho moins 1 molécule de H2O
Exemple: le H4P2O7 est appelé
acide pirophosphorique car il est égal à deux molécules d'acide orthophosphorique (H3POUSSIÈRE4) moins une molécule d'eau.2. H3POUSSIÈRE4 =H6P2O8
H6P2O8 -H2O = H4P2O7
Ce processus est un déshydratation intermoléculaire:
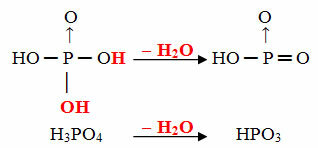
- Objectif: 1 molécule d'ortho moins 1 molécule de H2O
Exemple: le HPO3 est appelé acide butphosphorique car il est égal à une molécule d'acide orthophosphorique (H3POUSSIÈRE4) moins une molécule d'eau.
H3POUSSIÈRE4 -H2O = HPO3
Ce processus est un déshydratation intramoléculaire:
Par Jennifer Fogaça
Diplômé en Chimie
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
FOGAÇA, Jennifer Rocha Vargas. « Degré d'hydratation des acides »; École du Brésil. Disponible en: https://brasilescola.uol.com.br/quimica/grau-hidratacao-dos-acidos.htm. Consulté le 28 juin 2021.
L'acide orthophosphorique a la formule moléculaire suivante: H3POUSSIÈRE4. À partir de là, cochez l'alternative qui indique respectivement l'acide pyrophosphorique et l'acide métaphosphorique :
Degré d'ionisation, acide chlorhydrique, volatilité, acide acétique, Svante Arrehenius, les acides conduisent l'électricité, réactions de neutralisation, Réaction avec des carbonates et bicarbonates, solution de phénolphtaléine rouge, papier de tournesol bleu.