À forces intermoléculaires sont un sujet en chimie qui, à coup sûr, peut apparaître dans l'examen national du lycée (Et soit). Par conséquent, il vaut la peine de vérifier le contenu principal de ce sujet dans cet article.
Définition
forces intermoléculaires ce sont des forces – d'intensité variable (faible, moyenne ou forte) – d'attraction électrostatique ou des liaisons établies entre les molécules d'une substance qui maintiennent l'union entre elles.
Types de forces intermoléculaires
Le) Dipôle induit
Et le force intermoléculaire qui se produit entre les molécules d'une substance avec une caractéristique non polaire. Cela se produit, par exemple, entre des molécules de substances telles que O2, H2, non2, CO2, CH4.
L'union entre ces molécules se produit lorsqu'un dipôle est créé entre elles. Cela se produit lorsque les électrons d'une molécule déplacent les électrons d'une autre, créant ainsi un pôle négatif et un pôle positif, qui sont transférés d'une molécule à une autre.
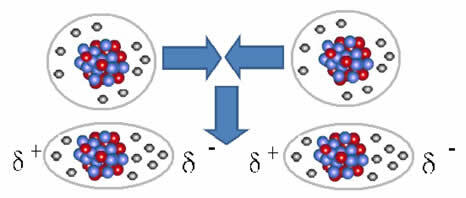
Représentation de la formation de dipôles dans les molécules non polaires
Entre ces molécules, deux pôles se sont formés et le pôle négatif de l'un interagit avec le pôle positif de l'autre. Parce que ces pôles ont été créés, il s'agit d'une force intermoléculaire de faible intensité.
B) dipôle permanent
Et le force intermoléculaire qui se produit entre les molécules d'une substance avec une caractéristique polaire. Des exemples sont des molécules de substances telles que HCN, H2O, NH3, CO, CH3Cl.
L'union entre ces molécules se produit lorsque le pôle négatif de l'une interagit avec le pôle positif de l'autre.
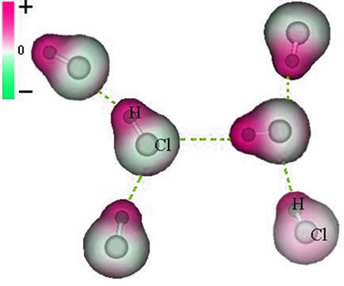
Représentation de la force dipolaire permanente entre les molécules d'HCl
Comme les pôles existent déjà, la force intermoléculaire permanente du dipôle est plus intense que le dipôle induit.
ç) liaisons hydrogène
Cette force intermoléculaire il se produit entre des molécules polaires qui ont un atome d'hydrogène lié directement à un atome d'oxygène, d'azote ou de fluor.
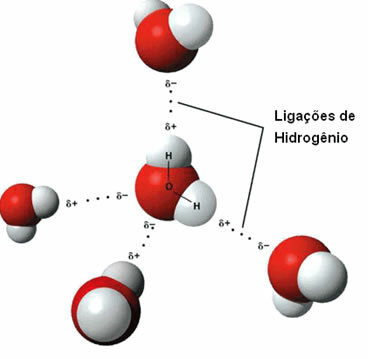
Représentation des liaisons hydrogène entre les molécules d'eau
Une liaison hydrogène se forme lorsque l'hydrogène d'une molécule interagit avec l'oxygène, l'azote ou le fluor de l'autre molécule.
d) ion dipolaire
Cette force intermoléculaire se produit entre une molécule polaire, qui a une paire d'électrons non liés, et un ion (cation ou anion) dans la solution.
La molécule d'eau, par exemple, a deux paires d'électrons non liants dans l'oxygène. S'il y a des ions dans le milieu aqueux, ils se rapprochent de la molécule d'eau, car il y a des pôles à l'intérieur.
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
Importance
L'importance de connaître les forces intermoléculaires pour Enem c'est la compréhension qu'ils apportent concernant les états physiques, le point de fusion, le point d'ébullition et la solubilité des substances.
Le) Relation avec le point de fusion et d'ébullition de la substance
Le point de fusion indique la température de transition d'un état solide à un état liquide et le point d'ébullition indique la température de transition d'un état liquide à un état gazeux.
Ce passage est directement lié à l'interaction entre les molécules de la substance, car ce qui différencie un état physique d'un autre est le niveau d'agrégation entre ses molécules.
Ainsi, plus la force intermoléculaire est intense, plus les points de fusion et d'ébullition sont élevés. Moins la force intermoléculaire est intense, plus les points de fusion et d'ébullition sont bas. Ainsi, on peut définir l'ordre décroissant des points de fusion et d'ébullition :
Liaison hydrogène > dipôle permanent > dipôle induit
B) Relation avec la solubilité
En général, nous devrions savoir que le semblable dissout le semblable, c'est-à-dire que la substance polaire dissout la substance polaire et la substance non polaire dissout la substance non polaire.
Cependant, il existe toujours une possibilité d'interaction entre les molécules de soluté et les molécules de solvant. Cela ne se produit que si cette nouvelle interaction est supérieure à ce qui existe déjà entre les molécules de la substance elle-même.
Exemple d'application de la force intermoléculaire dans Enem
1er exemple: (Enem-2011) La peau humaine, lorsqu'elle est bien hydratée, acquiert une bonne élasticité et un aspect doux et lisse. En revanche, lorsqu'il est sec, il perd de son élasticité et apparaît opaque et rugueux. Pour prévenir le dessèchement cutané, il est nécessaire, dans la mesure du possible, d'utiliser des crèmes hydratantes hydratantes, généralement à base de glycérine et de polyéthylène glycol :

La rétention d'eau à la surface de la peau favorisée par les hydratants est une conséquence de l'interaction des groupes hydroxyles des agents mouillants avec l'humidité contenue dans l'environnement à travers :
a) liaisons ioniques
b) Forces de Londres
c) liaisons covalentes
d) forces dipôle-dipôle
e) liaisons hydrogène
La réponse à cette question est la liaison hydrogène, car la molécule d'eau a de l'hydrogène lié à un atome d'oxygène. Il en va de même avec les molécules de propylène glycol et de polyéthylène glycol, une condition favorable à l'apparition de ce type de force intermoléculaire.
Par moi Diogo Lopes Dias
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
JOURS, Diogo Lopes. "Forces intermoléculaires dans Enem"; École du Brésil. Disponible en: https://brasilescola.uol.com.br/quimica/forca-intermoleculares-no-enem.htm. Consulté le 27 juin 2021.

