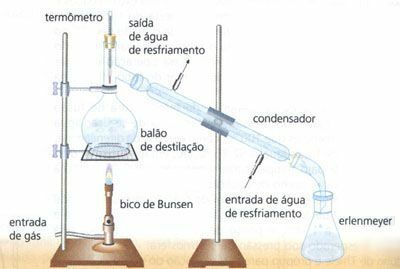
Les forces intermoléculaires sont celles responsables du maintien des molécules ensemble dans la formation de différents composés, elles sont classées comme suit :
Force induite par les dipôles: elle est causée par l'accumulation d'électrons dans une certaine région de la molécule.
Les interactions intermoléculaires présentes dans les molécules non polaires sont induites par les dipôles, mais elles ne se produisent pas tout le temps, la distribution des électrons dans l'électrosphère de ces molécules est uniforme. Cependant, à un moment donné il y a une accumulation de charges + et - (pôles) aux extrémités, c'est là que les forces des dipôles induits apparaissent et, comme leur nom l'indique, ils induisent également des molécules voisines à entrer en déséquilibre.
Voir des exemples de composés non polaires dont les molécules interagissent par des forces induites par les dipôles :
Cl2, CO2, CH4, H2, ô2
Forces dipôle-dipôle: force intermoléculaire présente dans les composés polaires.
δ + δ- δ + δ- δ + δ-
H? Frère H? Frère H? fr
Notez que dans les molécules d'acide bromhydrique (HBr) il y a des pôles δ + et δ-, ils sont responsables du fait que cette molécule soit polaire.
Exemples de composés polaires dans lesquels se produit une interaction dipôle-dipôle :
H2S, CO, SO2, HCl
Liaisons hydrogène: Il s'agit de l'interaction la plus forte qui se produit entre les molécules, par rapport à la force dipôle-dipôle beaucoup plus améliorée. Cette liaison se produit entre des molécules qui contiennent des atomes d'hydrogène liés à des atomes d'azote, le fluor, l'oxygène, c'est-à-dire des éléments très électronégatifs, donc les pôles δ + et δ- sont plus accentué.
La molécule d'eau est un exemple classique de liaisons hydrogène, où les atomes H se lient étroitement avec les atomes H d'autres molécules pour former la chaîne H.20.
Voyez quelle force intermoléculaire est la plus intense à travers la figure ci-dessous :

La flèche indique l'ordre croissant d'intensité d'interaction.
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
Par Líria Alves
Diplômé en Chimie
Équipe scolaire du Brésil
Voir plus :
Forces intermoléculaires et solubilité
Expérience qui permet de tester quelle substance est polaire et non polaire.
Chimie générale - Chimie - École du Brésil
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
FOGAÇA, Jennifer Rocha Vargas. "Types de forces intermoléculaires"; École du Brésil. Disponible en: https://brasilescola.uol.com.br/quimica/tipos-forcas-intermoleculares.htm. Consulté le 27 juin 2021.
Chimie

Accédez à ce lien et découvrez la fonction organique des phénols, un groupe de substances oxygénées, à partir de grande réactivité, dont l'acidité est supérieure à celle des alcools (composés qui ont aussi un groupe hydroxyle). Sa structure se distingue par la présentation d'un groupe hydroxyde (OH) directement lié à un composé aromatique.