En général, le substances pures se trouvent à peine isolés dans la nature, se trouvant sous la forme de mélanges, c'est-à-dire associé à d'autres substances. Cela signifie que nous et presque tout ce qui nous entoure sommes des exemples de mélanges de substances pures les plus variées.
Dans ce texte, nous apprendrons ce que c'est et quelles sont les classifications des substances pures et des mélanges.
substances pures
substances pures sont des matériaux qui ont une composition chimique et Propriétés physiques et chimiques constants, car ils ne changent pas à pression et température constantes.
D'une manière générale, les substances pures peuvent être classées de deux manières :
a) Substances simples
Ce sont des composés chimiques formés par des atomes d'un même élément chimique. Par example:
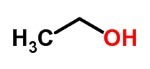
→ H2 (Gaz hydrogène)
Les molécules d'hydrogène gazeux sont formées de deux atomes de l'élément chimique hydrogène, c'est donc une substance simple.
→ O3 (Ozone gazeuse)
Les molécules de gaz d'ozone sont formées de trois atomes de l'élément chimique Oxygène, c'est donc une substance simple.
Il existe également la possibilité que les atomes d'un même élément chimique forment des substances simples complètement différentes, les allotropes. Un exemple de allotropie c'est le cas de l'élément chimique Oxygène, qui forme les substances gazeuses oxygène (O2) et l'ozone gazeux (O3).
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
B) substances composées
Ce sont des composés chimiques formés par des atomes de différents éléments chimiques. Exemples:
→ CO2 (gaz de carbone ou dioxyde de carbone)
Les molécules de dioxyde de carbone sont formées par un atome de l'élément carbone et deux atomes de l'élément oxygène. Comme les éléments chimiques sont différents, c'est une substance composée.
→ kmnO4 (Le permanganate de potassium)
O formule ionique de permanganate de potassium est formé par un atome de l'élément potassium, un atome de l'élément manganèse et quatre atomes de l'élément oxygène.
Carte mentale: substance pure et mélange

* Pour télécharger la carte mentale en PDF, Cliquez ici!
Mélanges
Mélanger c'est l'union de deux ou plusieurs substances différentes (qu'elles soient simples ou composées). Il présente des caractéristiques physiques (point de fusion, point d'ébullition, densité, ténacité, etc.) différentes et variables (non fixes) par rapport aux substances qui le composent.
Un mélange d'eau et de chlorure de sodium, par exemple, a un point de fusion totalement différent par rapport aux points de fusion de l'eau ( 0OC) et du chlorure de sodium (803OC) seul.
a) Mélanges homogènes
La solution saline est un mélange homogène formé d'eau, de glucose et de chlorure de sodium
Les mélanges homogènes n'ont qu'une seule phase (un seul aspect visuel). Ils se forment lorsqu'un matériau a la capacité d'en dissoudre un autre. Exemples:
eau et chlorure de sodium;
eau et glucose;
essence et éthanol;
air atmosphérique (oxygène gazeux, azote gazeux, dioxyde de carbone, vapeur d'eau, etc.);
acide acétique et eau;
pétrole (essence, kérosène, huile lubrifiante, etc.);
saline.
b) Mélanges hétérogènes

Le lait est un mélange hétérogène car il a une phase liquide (eau) et une phase solide (graisse)
Les mélanges hétérogènes ont plus d'une phase (deux ou plusieurs aspects visuels). Ils se forment lorsqu'un matériau n'en dissout pas un autre. Exemples:
Granit;
Lait;
Du sang;
Eau et sable;
L'eau c'est Léo ;
Eau et essence.
* Carte mentale de Victor Ricardo Ferreira
Professeur de chimie
Par moi Diogo Lopes Dias
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
JOURS, Diogo Lopes. « Substances pures et mélanges »; École du Brésil. Disponible en: https://brasilescola.uol.com.br/quimica/mistura-e-substancias-puras.htm. Consulté le 28 juin 2021.
Chimie

Voir la définition des concepts de base de la chimie tels que matière, énergie, substance, mélange, corps, objet, masse, volume et système.