Dans le texte "Concentration en mol/L ou Molarité” vous avez vu que la concentration en mol/L se rapporte à la quantité de matière dans le soluté (n1, mesuré en mol) avec le volume de la solution en litres (V). Cependant, certains solutés, lorsqu'ils sont placés dans l'eau, génèrent des ions.
Un exemple est lorsque nous mettons du sel (NaCl) dans l'eau, une attraction se produit entre le pôle positif de l'eau avec Cl et le pôle négatif avec Na, donnant lieu à des ions Na+ et Cl-.
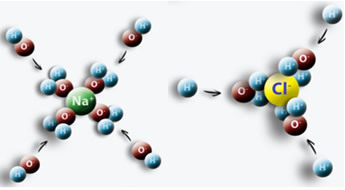
Il est important de savoir déterminer la concentration en mol/L de ces ions, car cela peut être utile dans de nombreuses situations. Un domaine qui l'utilise est la médecine, en particulier dans les tests sanguins médicaux. Notre sang et d'autres fluides corporels contiennent des ions dissous. Si la concentration de ces ions dans notre sang est supérieure ou inférieure à la normale, cela peut compromettre le bon fonctionnement de notre organisme et entraîner des troubles et des maladies.
Voir le cas des ions fer (Fe
2+): si la personne manque de cet ion, elle peut développer une anémie. Ainsi, lorsqu'on dit à quelqu'un qui souffre d'anémie qu'il doit consommer des aliments riches en fer ou même des médicaments contenant du fer, il s'agit en fait de l'ion fer et non de l'élément métallique.Un autre cas est lorsqu'il y a une perte d'ions calcium (Ca2+) dans les os, provoquant l'ostéoporose, comme le montrent les photos avec des images agrandies des os ci-dessous :

Regardez d'autres exemples d'ions qui ont des fonctions vitales dans notre corps et doivent être dans la bonne concentration :

Par conséquent, compte tenu de ces informations, il devient évident que savoir calculer la concentration d'ions dans les solutions est vraiment important. Mais comment cela peut-il se faire?
Il est possible de déterminer les concentrations en mol/L des ions présents dans les solutions si l'on connaît deux données essentielles qui sont :
- Les formules des substances dissoutes dans l'eau ;
- La molarité de vos solutions.
Avec ces données en main, écrivez l'équation de dissociation ou d'ionisation du soluté en question et trouvez par déduction la concentration des ions, comme il est proportionnel au nombre de moles de chaque ion. Cela signifie que la concentration des ions est proportionnelle à leurs coefficients respectifs dans l'équation d'ionisation ou de dissociation.
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
Voir l'exemple suivant pour mieux comprendre comment ce calcul est effectué :
"Considérer que la concentration en quantité de matière d'une solution aqueuse donnée de phosphate de magnésium (Mg3(POUSSIÈRE4)2 est de 0,5 mol/L. Quelle sera la concentration en mol/L de cations magnésium (Mg2+(ici)) et les anions phosphate (PO3-4(aq)) dans cette solution, en considérant que le degré de dissociation (α) était de 100 %? »
La première étape pour résoudre ce problème consiste à écrire l'équation de dissociation ou d'ionisation. Si vous rencontrez des difficultés, vous pouvez vous baser sur l'équation générique ci-dessous :
1 AXBoui → xA+y + yB-X
1 mol x mol y mol
Donc, en considérant dans cet exemple que le phosphate de magnésium s'est complètement dissocié, on a l'équation suivante :
1 mg3(POUSSIÈRE4)2(aq) → 3 mg2+(ici) + 2 po3-4(aq)
1 mol 3 mol 2 mol
Nous pouvons voir que 1 mole de Mg3(POUSSIÈRE4)2 donne 3 mol de Mg2+(ici) et 2 mol de PO3-4(aq); ainsi, le nombre de moles du cation sera 3 fois le nombre de moles du phosphate avec lequel la solution a été préparée, et celui des anions sera 2 fois.
Comme la solution est à 0,5 mol/L de Mg3(POUSSIÈRE4)2(aq) , cela signifie que 0,5 mol de Mg a été dissous dans 1 L de celui-ci3(POUSSIÈRE4)2, ce qui a donné lieu à 1,5 mol/L de Mg2+(ici) et 1,0 mol/L de PO3-4(aq):
1 mg3(POUSSIÈRE4)2(aq) → 3 mg2+(ici) + 2 po3-4(aq)
1 mol 3 mol 2 mol
0,5 mol x y
1. 0,5 3. 0,5 2. 0,5
0,5 mol/L 1,5 mol/L1,0 mol/L
Mais que faire si le degré de dissociation ou d'ionisation n'était pas de 100 %? Disons que c'était 70%, comment ferions-nous pour connaître la concentration mol/L de ces ions ?
Dans ce cas, effectuez simplement une simple règle de trois. Voir ci-dessous:
1,5 mol/L de Mg2+(ici) 100 %
x 70 %
x = 70. 1,5 → x = 1,05 mol/L d'ions Mg2+(ici)
100
1,5 mol/L de PO3-4(aq) 100 %
oui 70 %
y = 70. 1,0 → y = 0,70 mol/L d'ions PO3-4(aq)
100
Par Jennifer Fogaça
Diplômé en Chimie
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
FOGAÇA, Jennifer Rocha Vargas. "Concentration ionique en mol/L"; École du Brésil. Disponible en: https://brasilescola.uol.com.br/quimica/concentracao-dos-ions-mol-l.htm. Consulté le 28 juin 2021.
Chimie

Dissociation et ionisation, scientifique italien Volta, courant électrique, physico-chimiste suédois Svant August Arrhenius, théorie de Arrhenius, ions positifs, cations, ions négatifs, anions, soude caustique, sel de table, molécules polaires, dissociation ionique,


