LES oxydation légère dans les alcènes est une réaction organique effectuée lorsqu'un alcène est placé dans un milieu formé d'une base avec de l'eau et du sel de permanganate de potassium (KMnO4), sel communément appelé Réactif de Bayer.
Le produit formé est appelé de l'alcool vicinaux, c'est-à-dire les alcools qui ont deux groupes hydroxyle (OH-) positionnés sur des carbones voisins, comme dans la formule générale suivante :
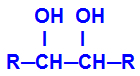
REMARQUE: R peut être un radical ou des atomes d'hydrogène.
Réactif Bayer
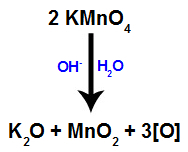
Quand le réactif de Bayer (KMnO4) est mélangé avec de l'eau en présence de base inorganique (OH-), il réagit et forme de l'oxyde de potassium (K2O), dioxyde de manganèse (MnO2) et les oxygènes naissants (oxygène libre, représenté par [O]). Voir l'équation équilibrée du processus.

Ces oxygènes naissants formés à partir du réactif de Bayer sont responsables de la réaction d'oxydation modérée des alcènes (comme nous le verrons dans les éléments suivants).
Mécanismes dans une réaction d'oxydation douce dans les alcènes
1er mécanisme : formation d'oxygènes naissants à partir du réactif de Bayer ;
2ème mécanisme : Attaque des oxygènes naissants à la double liaison présente dans l'alcène, provoquant la perturbation de la liaison pi et formation consécutive d'une valence libre dans chacun des carbones impliqués dans le lien pi.
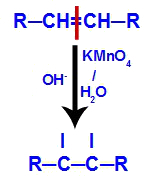
3ème mécanisme : Les oxygènes naissants s'unissent aux hydroniums (H+) formé à partir de l'auto-ionisation de l'eau, donnant naissance à des groupes hydroxyle (OH-).
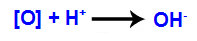
4ème mécanisme : Connexion des hydroxyles formées dans chacune des valences libres situées sur les carbones où se trouvait la liaison pi, à l'origine d'un dialcool vicinal.

Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
Exemples de réactions d'oxydation douces dans les alcènes
→ Réaction d'oxydation douce sur le but-2-ène
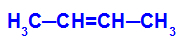
Formule développée du but-2-ène
Initialement, la double liaison entre les carbones 2 et 3 de l'alcène est rompue par l'attaque des oxygènes naissants, créant une valence libre (trace verticale) sur les carbones 2 et 3.

Rupture de la liaison pi entre les carbones 2 et 3 dans le but-2-ène
Ensuite, l'oxygène naissant s'unit à un hydronium (H+) à partir de l'ionisation de l'eau, formant des groupes hydroxyles (OH-), qui se lient aux valences libres des carbones 2 et 3, résultant en un dialcool vicinal.
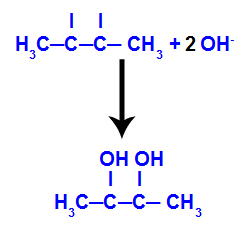
Alcool vicinal formé à partir de but-2-ène
→ Réaction d'oxydation douce sur 2-méthyl-propène
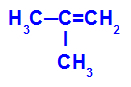
Formule développée du 2-méthyl-propène
Initialement, la double liaison entre les carbones 1 et 2 de l'alcène est rompue par l'attaque des oxygènes naissants, créant une valence libre (trace verticale) sur les carbones 1 et 2.
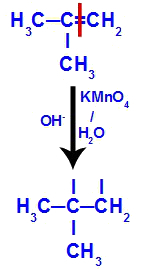
Rupture de la liaison pi entre les carbones 1 et 2 dans le 2-méthyl-propène
Ensuite, l'oxygène naissant s'unit à un hydronium (H+) à partir de l'ionisation de l'eau, formant des groupes hydroxyles (OH-), qui se lient aux valences libres des carbones 1 et 2, résultant en un dialcool vicinal.
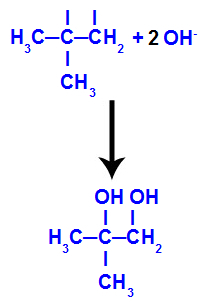
Alcool vicinal formé à partir de 2-méthyl-propène
Par moi Diogo Lopes Dias
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
JOURS, Diogo Lopes. « Légère oxydation des alcènes »; École du Brésil. Disponible en: https://brasilescola.uol.com.br/quimica/oxidacao-branda-alcenos.htm. Consulté le 28 juin 2021.
Chimie

Fonction hydroxyle, Alcools primaires, Alcools secondaires, Alcools tertiaires, Méthanol, Glycérol, Ethanol, préparation de nitroglycérine, fabrication de peintures, production de boissons alcoolisées, acide acétique, carburant automobiles.