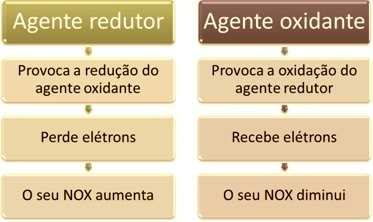
L'une des principales caractéristiques qui distinguent une réaction d'oxydoréduction (ou redox) des autres est la présence d'un agent oxydant et d'un agent réducteur, qui peuvent être définis comme suit :
Par exemple, regardez la réaction chimique ci-dessous où l'aluminium (Al) se corrode dans une solution aqueuse d'acide chlorhydrique (HCl). Les atomes d'aluminium transfèrent des électrons aux cations H+(ici) et produire le cation Al3+(ici):
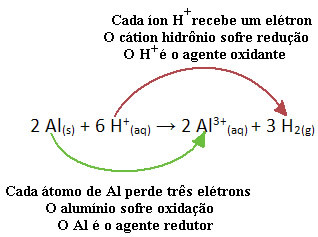
Notez que puisque Al a transféré des électrons, cela signifie que il a causé la réduction des cations H+(ici); c'est pourquoi il s'appelle agent réducteur. Déjà le cation H+(ici) enlevé les électrons de l'aluminium, provoquant l'oxydation de ce métal; il agit donc comme un agent d'oxydation.
Dans la vie de tous les jours, les exemples de performances des agents oxydants et des agents réducteurs sont nombreux. Regardez-en quelques-uns et rappelez-vous cependant que dans tous les cas la réduction se produit simultanément avec l'oxydation; donc, s'il y a un agent réducteur, il y a aussi un agent oxydant.
- Exemples d'agents réducteurs :
- Dans les films photographiques : les films photographiques contiennent des sels d'argent photosensibles. Aux points où il y a une incidence de lumière, il y a une réduction des ions Ag+, d'où le contraste observé dans les négatifs.

- Vitamine C: La vitamine C (acide L-ascorbique) est un puissant réducteur en solution aqueuse. Il a une facilité exceptionnelle à s'oxyder et c'est pourquoi il est largement utilisé, notamment dans des aliments tels qu'un antioxydant, c'est-à-dire qu'il est ajouté à d'autres aliments et les protège d'une éventuelle oxydation, en raison de sa propre sacrifice. Par exemple, les fruits comme les pommes et les poires s'assombrissent au contact de l'oxygène de l'air, car ils s'oxydent. Mais lorsque vous ajoutez une petite quantité de jus d'orange ou de citron (qui contiennent de la vitamine C) au fruit coupé, cela empêche cette réaction de se produire, car la vitamine C agit comme un agent réducteur et s'oxyde avant le fruit.

- Gaz hydrogène: l'hydrogène gazeux (H2) est utilisé dans la propulsion des fusées et est considéré comme l'une des alternatives énergétiques les plus importantes, car sa combustion libère une grande quantité d'énergie et aucun polluant. Dans cette réaction, l'hydrogène agit comme un agent réducteur, étant oxydé par l'oxygène.
- Exemples d'agents oxydants :
- Dans la fabrication du vinaigre : lorsque le vin est exposé à l'air, il se transforme en vinaigre dont le composant principal est l'acide acétique. En effet, l'alcool éthylique ou l'éthanol présent dans le vin s'oxyde au contact de l'oxygène atmosphérique, ce qui donne de l'acide acétique. Ainsi, l'oxygène est un agent oxydant. Même l'origine du terme « oxydation » est liée à la réaction avec l'oxygène.

Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
- Dans la rouille : comme indiqué dans l'exemple précédent, l'oxygène agit comme agent oxydant pour l'alcool; et il le fait également au contact de divers métaux, tels que le fer, provoquant le processus de rouille. En plus de l'oxygène de l'air, d'autres agents oxydants dans ce cas sont l'eau ou une solution acide.
- Dans les agents de blanchiment : l'effet blanchissant des agents de blanchiment est dû à la présence des deux agents réducteurs suivants: o anion hypochlorite (généralement sous forme de sel de sodium – NaOCl), présent par exemple dans l'eau de Javel; et le peroxyde d'hydrogène (H2O2), commercialisé sous le nom de peroxyde d'hydrogène. Ces deux composés ont une très forte tendance à s'oxyder et à provoquer la réduction d'autres espèces chimiques. Par conséquent, ils sont responsables de substances oxydantes qui donnent une couleur foncée aux produits. Par exemple, dans la cellulose, la lignine est décomposée et devient plus légère et plus malléable. Dans le cas du détachage et du blanchiment des tissus, ces agents oxydants provoquent l'oxydation des molécules organiques telles que les graisses et les colorants.

- Dans les alcootests : un éthylotest simple jetable se compose d'un tube transparent contenant une solution aqueuse de sel de dichromate de potassium et de silice, humidifiée avec de l'acide sulfurique; mélangé avec la couleur orange. Ce sel, au contact des vapeurs d'alcool contenues dans l'haleine du conducteur ivre, réagit en virant au vert. Cela signifie que l'oxydation de l'éthanol (alcool) en éthanol est provoquée.

Par Jennifer Fogaça
Diplômé en Chimie
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
FOGAÇA, Jennifer Rocha Vargas. « Concept et exemples d'agent réducteur et d'agent oxydant »; École du Brésil. Disponible en: https://brasilescola.uol.com.br/quimica/conceito-exemplos-agente-redutor-agente-oxidante.htm. Consulté le 28 juin 2021.
Chimie

Acier résistant à la corrosion atmosphérique, Chrome, Nickel, fabriqué à partir de fonte brute dans les hauts fourneaux, résistance à oxydation à haute température, Acier inoxydable, groupe d'alliages ferreux résistant à l'oxydation et à la corrosion, fabrication de pièces pour véhicule
Chimie

Fonctionnement de l'éthylotest, concentration d'alcool, éthylotest, réactions impliquant l'alcool éthylique, types de alcootests, dichromate de potassium, pile à combustible, catalyseur, libération d'électrons, acide acétique, hydrogène, conce
Chimie

Verres photosensibles, réactions d'oxydo-réduction, perte ou gain d'électrons, verres photosynthétiques dans les lunettes de soleil, composition de verre photochromatique, atomes d'oxygène tétraédriques, structure cristalline du chlorure d'argent, lumière ultraviolette, métal argenté



