LES hydrolyse du sel entre les acides forts et les bases il se produit lorsque le cation dans un sel n'interagit pas avec l'anion dans l'eau et que l'anion dans le sel n'interagit pas avec le cation dans l'eau. L'hydrolyse entre les cations et les anions d'un sel et de l'eau ne se produit que lorsque le produit formé est un acide faible, une base faible ou les deux. Comprendre pas à pas l'hydrolyse des sels entre acides forts et bases fortes :
a) Étape 1: ionisation de l'eau
L'eau est une substance qui a la capacité de souffrir auto-ionisation, c'est-à-dire qu'il produit un cation hydronium (H+) et l'anion hydroxyde (OH-) de sa structure.
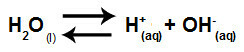
Équation représentant l'auto-ionisation de l'eau
b) Étape 2: Dissociation de sel
Lorsqu'un sel est ajouté à l'eau, il passe par le processus de dissociation. Comme le sel est un composé ionique, dans l'eau, ses cations et anions sont libérés dans le milieu, comme dans l'équation ci-dessous :
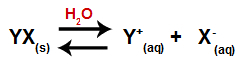
Équation représentant la dissociation de tout sel
c) Étape 3: Hydrolyse saline des acides et bases forts
Pour l'acide fort : lorsque l'anion du sel combiné avec le H+ d'eau pour former HCl, HBr, HI ou un autre acide dans lequel la soustraction du nombre d'oxygènes par le nombre d'hydrogènes est égale ou supérieure à 2, nous aurons un acide fort. Par conséquent, la combinaison entre les ions mentionnés ne se produit pas.
Pour des bases solides : lorsque le cation du sel appartenant aux familles IA (métaux alcalins) ou IIA (métaux alcalino-terreux autres que le magnésium) est associé à l'OH- d'eau, il formera un base solide. Par conséquent, la combinaison entre les ions mentionnés ne se produit pas.
Lorsque les ions sel n'interagissent pas avec les ions eau, nous avons l'équation suivante :
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
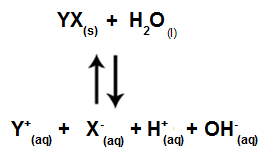
Équation montrant tous les ions présents dans la solution
En résumé, comme les ions sel n'interagissent pas avec les ions eau, les ions sel ne favorisent aucun changement dans la solution finale. Ainsi, nous pouvons écrire l'équation d'une hydrolyse du sel entre des acides forts et des bases fortes juste avec l'équation d'ionisation de l'eau.
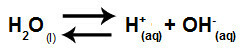
Équation représentant l'hydrolyse des acides et bases forts
d) Exemple d'hydrolyse du sel entre des acides forts et des bases
Lorsque nous ajoutons le sel de chlorate de potassium à l'eau (KClO3), le sel se dissocie et libère le cation potassium (K+) et l'anion chlorate (ClO3-) au milieu.
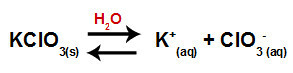
Équation de dissociation pour le chlorate de potassium
Il est important de se rappeler que l'eau subit une auto-ionisation et fournit au milieu un cation hydronium (H+) et l'anion hydroxyde (OH-). Il faut maintenant évaluer l'interaction entre les ions sel et eau.
Lorsque le H+ interagit avec ClO3-, il forme de l'acide perchlorique (HclO3). Puisque la soustraction du nombre d'oxygènes par le nombre d'hydrogènes ionisables dans l'acide perchlorique est de 2, elle est forte. Par conséquent, l'interaction entre les ions ne se produit pas.
Lorsque le cation K+ interagit avec l'anion OH-,nous avons la formation d'une base forte, car le potassium est un métal alcalin. Par conséquent, l'interaction entre les ions ne se produit pas.
L'équation qui représente l'hydrolyse du sel entre les acides forts et les bases à partir de la dissolution du chlorate de potassium dans l'eau est :
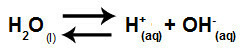
Équation chimique de l'hydrolyse du chlorate de potassium
Par moi Diogo Lopes Dias
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
JOURS, Diogo Lopes. "Hydrolyse saline entre acides forts et bases fortes"; École du Brésil. Disponible en: https://brasilescola.uol.com.br/quimica/hidrolise-salina-entre-acidos-bases-fortes.htm. Consulté le 28 juin 2021.
Chimie

Testez vos connaissances et apprenez-en plus avec cette liste d'exercices résolus sur les équilibres chimiques. Grâce à ce matériel, vous pourrez mieux comprendre comment travailler les constantes d'équilibre (Kp, Kc et Ki), le décalage d'équilibre, le pH et le pOH, ainsi que l'équilibre dans les solutions dites tampons.
