Kemiallisen reaktion tapahduttamiseksi on tarpeen täyttää neljä perusedellytystä, jotka ovat:
1. Reagenssien on otettava yhteyttä;
2. Reagenssien välillä on oltava kemiallinen affiniteetti;
3. Reagenssihiukkasten törmäysten on oltava tehokkaita;
4. Aktivointienergia on saavutettava.
Katso lyhyesti jokainen tapaus:
1.Reagenssien välinen kosketus:
Tämä ehto on ilmeinen, koska vaikka reagensseilla olisi paljon affiniteettia toisiinsa, kuten happojen ja emästen tapauksessa, jos ne erotetaan, reaktiota ei tapahdu. Niiden on oltava yhteydessä toisiinsa, jotta niiden hiukkaset voivat törmätä, murtamalla reagenssien sidokset ja muodostamalla tuotteiden sidokset.

2.Kemiallinen affiniteetti:
Kuten olemme nähneet, reagenssien saattaminen kosketukseen on välttämätöntä, mutta ei tarpeeksi. Esimerkiksi jos natrium saatetaan kosketuksiin veden kanssa, tapahtuu erittäin väkivaltainen reaktio, mutta jos laitamme kultaa, emme näe eroa. Tämä johtuu siitä, että eri aineilla on erilaiset kemialliset affiniteetit toisiinsa, tai niillä ei ehkä ole lainkaan affiniteettia. Mitä suurempi kemiallinen affiniteetti, sitä nopeampi reaktio.
Mainituissa esimerkeissä natriumilla on suuri affiniteetti veteen niin paljon, että metallista natriumia varastoidaan petroliin, jotta se ei pääse kosketuksiin ilman kosteuden kanssa. Kulta on inerttiä, minkä vuoksi kultamuistomerkit kestävät niin kauan, kuten Egyptin sarkofagit.

3.Törmäysteoria:
Jopa yhdisteissä, joilla on kemiallinen affiniteetti, reaktion etenemiseksi on välttämätöntä, että niiden hiukkaset, atomit tai molekyylit törmäävät tehokkaasti. Kaikki törmäävät hiukkaset eivät tee tätä tehokkaasti, mutta iskut, jotka johtavat rikkoutumiseen reagenssisidokset ja uusien sidosten muodostuminen ovat niitä, jotka tapahtuvat oikeassa suunnassa ja energian mukana tarpeeksi.
Älä lopeta nyt... Mainonnan jälkeen on enemmän;)
Alla on esitetty kaksi tehotonta törmäystä ja yksi tehokas törmäys, joka johtaa reaktion tapahtumiseen.
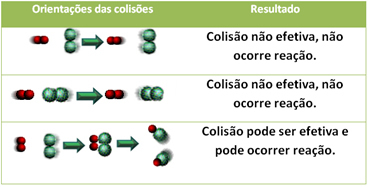
4.Aktivointienergia ja aktivoitu kompleksi:
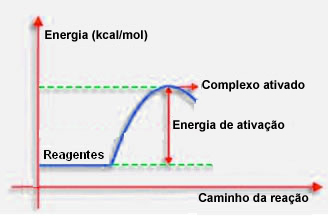
Kuten edellisessä kohdassa todettiin, tehokas törmäys tarvitsee suotuisan ohjauksen lisäksi myös riittävästi energiaa. Kutakin reaktiota varten tarvittavaa minimimäärää energiaa kutsutaan aktivointienergiaksi.
Jos reaktanttien energia on yhtä suuri tai suurempi kuin aktivointienergia, hyvin suunnatun iskun aikana muodostuu alun perin aktivoitu kompleksi, joka on välirakenne reagenssien ja reaktorien välillä Tuotteet. Aktivoidussa kompleksissa muodostuu heikentyneitä reagenssisidoksia ja uusien tuotteiden sidoksia.
Aktivointienergia toimii siis eräänlaisena esteenä reaktion tapahtumiselle, koska mitä suurempi se on, sitä vaikeampi reaktio tapahtuu. Joissakin tapauksissa on tarpeen syöttää energiaa reagensseihin. Esimerkiksi keittokaasulla on affiniteetti vuorovaikutuksessa ilmassa olevan hapen kanssa, mutta meidän on toimitettava energiaa, kun koomme ottelun yhteen, muuten reaktio ei tapahdu. Mutta aloitettuaan reaktio itse vapauttaa tarpeeksi energiaa muiden molekyylien aktivoimiseksi ja reaktion pitämiseksi yllä.
Kirjailija: Jennifer Fogaça
Valmistunut kemian alalta
Haluatko viitata tähän tekstiin koulussa tai akateemisessa työssä? Katso:
FOGAÇA, Jennifer Rocha Vargas. "Kemiallisten reaktioiden esiintymisen ehdot"; Brasilian koulu. Saatavilla: https://brasilescola.uol.com.br/quimica/condicoes-para-ocorrencia-reacoes-quimicas.htm. Pääsy 27. kesäkuuta 2021.



