Yksi suurimmista haasteista kenenkään kemian oppijoille kutsutaan sähköiseksi jakeluksi. Se, mitä aiomme esittää tässä yhteydessä, voi helpottaa suuresti tutkijasi, joka liittyy tutkija Linus Paulingin ehdottamaan elektronikonfiguraatioon.
Kullekin kerrokselle tai energiatasolle sopiva elektronien enimmäismäärä on annettu taulukon kautta:
Energiatasokerros Elektronien enimmäismäärä
1. o 2
2. L 8
3. M 18
4. N 32
5 ° O 32
6.P 18
7. Q 8
Alatasojen kasvava energialuokka on järjestys lävistäjien järjestyksessä. Linus Pauling -kaavio on esitetty alla:
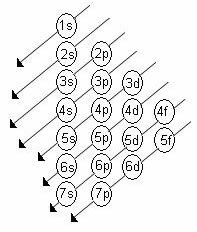
Perussäännöt:
1. Elementin atominumero (Z) neutraalissa tilassa osoittaa jaettavien elektronien lukumäärän. Tämä numero on esitetty elementtisymbolin vasemmassa alakulmassa.
2. Käynnistä elektronien jakautuminen Pauling-kaavion avulla ylhäältä alas ottaen huomioon kasvava energian järjestys (nuolien suuntaisesti suunnattu).
3. Täytä alatasot elektronien maksimitasolla. Jos tietyllä alatasolla on vain 6 elektronia, älä ylitä tätä määrää.
4. Tarkista elektronien määrä lisäämällä ne kullekin alatasolle.
Annetaan se käytännössä?
Levitä rautatomin elektronit (Z = 26).
Jos atomiluku on 26, se tarkoittaa, että normaalissa rautatomissa on 26 elektronia. Soveltamalla Pauling-kaaviota meillä on:

Kirjoittanut Líria Alves
Valmistunut kemian alalta
Lähde: Brasilian koulu - https://brasilescola.uol.com.br/quimica/regras-distribuicao-eletronica.htm
