Isotermisessä muunnoksessa tilavuuden ja paineen vaihtelu tietyn kaasun, mutta vakiolämpötila; tästä syystä isotermisen nimen (kreikan: iso = yhtä suuri; lämpö = lämpö).
Tutkijat Boyle ja Mariotte tekivät erikseen samanlaisia kokeita, ja saatu tulos oli: paineen kasvaessa kaasun tilavuus pienenee.
Ajatelkaapa esimerkiksi ruiskun mäntää. Jos käytämme ulkoista painetta tähän männään, toisin sanoen jos nostamme painetta, ruiskun sisällä olevan ilman määrä vähenee ja päinvastoin.
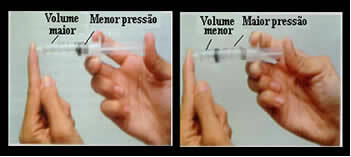
Tilavuus ja paine ovat kääntäen verrannollisia: vasemmassa paneelissa paine on pieni ja ilman käyttämä tilavuus on suuri. Oikealla, kun ruiskun mäntään kohdistetaan enemmän painetta, tilavuus pienenee.
Tämä ei ole yksittäinen tapaus, se on jotain, joka toistetaan säännöllisesti kaasuille. Siksi tämä tosiasia todettiin lain muodossa, joka voidaan kuvata seuraavasti:
| Boylen laki tai Boyle-Mariotten laki: Kiinteässä lämpötilassa kiinteän kaasumassan käyttämä tilavuus on kääntäen verrannollinen sen paineeseen. |
Tämä tarkoittaa, että jos kaksinkertaistamme kaasun paineen, sen tilavuus puolittuu ja niin edelleen. Kun kaksi tällaista määrää on kääntäen verrannollinen, niiden tulo on vakio; siis matemaattisesti tämä suhde voidaan esittää seuraavasti:
| P.V = k |
Missä k = vakio.
Jos siis ensimmäisessä tilanteessa tietyn kaasun paine-arvo on P1 ja sen vastaava tilavuus on V1, meidän on:
| P1. V1 = k |
Jos nostamme tämän paineen P2: ksi, myös sen tilavuus muuttuu V2: ksi, ja meidän on jälleen:
| P2 . V2 = k |
Siten pääsemme johtopäätökseen:
| P1. V1 = P2. V2 |
Tämä vakaus voidaan nähdä alla olevassa taulukossa annetulla esimerkillä kiinteän massan kaasun paineista ja tilavuuksista:
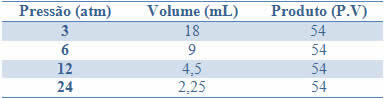
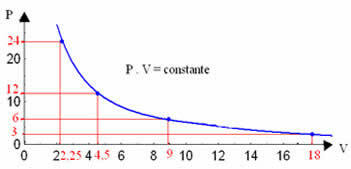
Piirtämällä nämä arvot näemme käyrän muodostumisen.
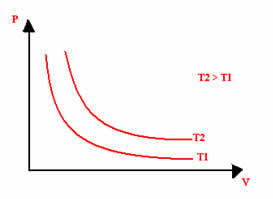
Isotermisen transformaation graafinen esitys on aina hyperboli riippumatta paineen, tilavuuden ja lämpötilan arvoista, joissa koe suoritettiin. Tätä hyperbolaa kutsutaan isotermi; joten, kuten alla olevasta kaaviosta voidaan nähdä, eri lämpötilat synnyttävät erilaisia isotermeja.
Lähde: Brasilian koulu - https://brasilescola.uol.com.br/quimica/transformacao-isotermica-ou-lei-boyle.htm

